 Aida Blanchett
Aida Blanchett
Elena Tione Presidente VULVODINIA.INFO ONLUS
 Qualifica professionale :
Qualifica professionale :
Mind-Body Health Coach per donne con dolore pelvico
Esci dal dolore ed Entra nella Tua Vita (c)!
Scopri come dire addio al tuo dolore pelvico
www.aidablanchett.com/mindbodynews
Instagram
www.instagram.com/elenationehealthylifecoach
Messaggi : 16107
Iscritto il : 17.10.10
Anno di nascita : 1977
Provincia di residenza : Roma
Comune : Roma Storia personale : • LA MIA STORIA e la fondazione di VULVODINIA.INFO e VULVODINIA.INFO ONLUS
Storia personale : • LA MIA STORIA e la fondazione di VULVODINIA.INFO e VULVODINIA.INFO ONLUS

Anche quest'anno non dimenticarti delle oltre 4 milioni di italiane che soffrono di vulvodinia!
Il tuo 5 per Mille per 1 donna su 7 Codice Fiscale 97 82 56 90 585
• Non sono un medico.
Tutti i consigli vanno seguiti sotto la propria respons-abilità e valutati col proprio medico curante, al quale nessuno senza gli stessi titoli e autorizzazioni può legalmente ed eticamente sostituirsi.
.
VULVODINIA.INFO ONLUS non è e non può essere ritenuto in alcun modo responsabile dei contenuti dei messaggi presenti nel Forum, scritti e inviati autonomamente dagli Utenti sotto loro piena e totale respons-abilità.
.
VULVODINIA.INFO ONLUS si riserva la facoltà, a suo insindacabile giudizio, di eliminare/modificare dal Forum i post aventi contenuto illegittimo, illegale o comunque lesivo di altrui diritti e dei contenuti ritenuti non in linea con il Regolamento completo e aggiornato della comunità.
.
I gestori di VULVODINIA.INFO ONLUS non si assumono in alcun modo alcuna respons-abilità per eventuali danni derivati a persone e cose tramite i messaggi inseriti nel Forum.
 Correlazione MBL (Mannose Binding Lectine) - Vulvodinia • VULVODINIA.INFO
Correlazione MBL (Mannose Binding Lectine) - Vulvodinia • VULVODINIA.INFO
Mar 02 Nov 2010, 20:49
Correlazione MBL - Vulvodinia
Volume 198, Issue 1, Pages 101.e1-101.e4 (January 2008)
[NB: MBL=Mannose Binding Lectine, "lectina legante il mannosio"]
Association between primary vulvar vestibulitis syndrome, defective induction of tumor necrosis factor-α, and carriage of the mannose-binding lectin codon 54 gene polymorphism
Volume 198, Issue 1, Pages 101.e1-101.e4 (January 2008)
[NB: MBL=Mannose Binding Lectine, "lectina legante il mannosio"]
Association between primary vulvar vestibulitis syndrome, defective induction of tumor necrosis factor-α, and carriage of the mannose-binding lectin codon 54 gene polymorphism
Oksana Babula, MD, Iara M. Linhares, MD, PhD, Ann Marie Bongiovanni, BS, William J. Ledger, MD, Steven S. Witkin, PhD
Received 12 September 2006; received in revised form 2 April 2007; accepted 23 May 2007.
Objective
We evaluated whether women with vulvar vestibulitis syndrome (VVS) could be subdivided on the basis of genotyping the polymorphic mannose-binding lectin (MBL) gene.
Study Design
DNA from 123 women with VVS was tested for a single nucleotide polymorphism at codon 54 of the MBL gene. Blood samples from 86 of the women were evaluated for ex vivo tumor necrosis factor-α (TNF-α) and interleukin-1 receptor antagonist (IL-1ra) production in response to Candida albicans, Gram-positive peptidoglycan, and Gram-negative lipopolysaccharide. Associations between laboratory findings and clinical characteristics were analyzed.
Results
The variant MBL*B allele was identified in 33 subjects (26.8%). This polymorphism was more prevalent in women whose symptoms developed at their first act of sexual intercourse (primary VVS, 40.9%), as opposed to women with secondary VVS (16.3%; P = .01). Ex vivo TNF-α production, but not IL-1ra production, was reduced in MBL*B carriers as compared with MBL*A homozygotes (P ≤ .03).
Conclusion
The MBL gene polymorphism is associated with the development of primary VVS and a reduced capacity for TNF-α production in response to microbial components.
Key words: Candida albicans, genetic polymorphism, mannose-binding lectin, tumor necrosis factor-α, vulvar vestibulitis syndrome
Division of Immunology and Infectious Diseases, Department of Obstetrics and Gynecology, Weill Medical College of Cornell University, New York, NY.
Reprints: Steven S. Witkin, MD, Department of Obstetrics and Gynecology, Weill Medical College of Cornell University, 525 East 68th St, Box 35, New York, NY 10021.
This work was supported in part by a grant from the National Vulvodynia Association.
Cite this article as: Babula O, Linhares IM, Bongiovanni AM, et al. Association between primary vulvar vestibulitis syndrome, defective induction of tumor necrosis factor-α, and carriage of the mannose-binding lectin codon 54 gene polymorphism. Am J Obstet Gynecol 2008;198;101.e1-101.e4.
http://www.ajog.org/article/S0002-9378(07)00676-X/abstract
2003: Gerber Stefan; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
Interleukin-1beta gene polymorphism in women with vulvar vestibulitis syndrome.
European journal of obstetrics, gynecology, and reproductive biology 2003;107(1):74-7.
OBJECTIVE: The pathogenesis of vulvar vestibulitis syndrome remains unknown but may be related to a localized chronic inflammation. The relation between this syndrome and a polymorphism at position +3953 in the interleukin-1beta gene was examined. Allele 2 of this gene has been associated with increased pro-inflammatory immunity. STUDY DESIGN: Buccal or vestibular swabs from 59 women with strictly defined vulvar vestibulitis and from 48 healthy women were tested by polymerase chain reaction for the presence of two alleles at the +3953 interleukin-1beta locus. RESULTS: Allele 2 of the interleukin-1beta gene was identified in 27 (46%) women with vulvar vestibulitis as opposed to 12 (25%) control women (P=0.03). The interleukin-1beta 1,1 genotype was present in 36 (75%) controls as opposed to 32 (54%) vulvar vestibulitis syndrome patients (P=0.02). All subjects had been previously tested for induced interleukin-1beta production in response to bacterial lipopolysaccharide. In both patients and controls, possession of allele 2 was associated with a small but non-statistically significant increase in induced interleukin-1beta production. CONCLUSION: Allele 2 in the interleukin-1beta gene is more common in women with vulvar vestibulitis syndrome than in other women. Susceptibility to vulvar vestibulitis syndrome might be influenced by carriage of this polymorphis
2000: Jeremias J; Ledger W J; Witkin S S
Interleukin 1 receptor antagonist gene polymorphism in women with vulvar vestibulitis.
American journal of obstetrics and gynecology 2000;182(2):283-5.
OBJECTIVE: Vulvar vestibulitis is a chronic inflammatory syndrome of unknown cause and pathogenesis. We examined the relation between vulvar vestibulitis and polymorphisms in the gene coding for the interleukin 1 receptor antagonist, a naturally occurring down-regulator of proinflammatory immune responses. STUDY DESIGN: Cells from the lower genital tract of 68 women with vulvar vestibulitis, 343 women with no history of vulvodynia, and 40 women with human papillomavirus cervical infection were tested by polymerase chain reaction for the different alleles of the gene encoding for interleukin 1 receptor antagonist. The presence of human papillomavirus in the specimens was determined by polymerase chain reaction with the use of degenerate consensus primers to the conserved L1 gene. RESULTS: Allele 2 of the gene encoding the interleukin 1 receptor antagonist was present in homozygous form in 52.9% of women with vulvar vestibulitis. In marked contrast only 8. 5% of the control women and 2.5% of women with human papillomavirus were homozygous for this allele (P
2002: Gerber Stefan; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
A deficiency in interferon-alpha production in women with vulvar vestibulitis.
American journal of obstetrics and gynecology 2002;186(3):361-4.
OBJECTIVE: Previous studies have suggested that interferon-alpha may be an effective treatment for some women with vulvar vestibulitis. We evaluated whether women with this syndrome had a deficiency in endogenous and induced interferon-alpha production. STUDY DESIGN: Blood was collected in heparinized tubes from 62 women with vulvar vestibulitis and 47 control women of similar age and ethnicity. Whole blood cultures were incubated in the presence of 0.1 ng/mL lipopolysaccharide (induced) or culture medium (uninduced) for 18 to 20 hours. Aliquots were tested for interferon-alpha levels by enzyme-linked immunosorbent assay. Vestibular samples were tested for human papillomavirus by polymerase chain reaction. Aliquots were also characterized for alleles of the polymorphic gene, interleukin-1 receptor antagonist, by polymerase chain reaction. RESULTS: In uninduced cultures, interferon-gamma was present in 68.1% of control subjects as opposed to 33.9% of vulvar vestibulitis patients ( P =.0005). Similarly, after lipopolysaccharide stimulation, 70.2% of control subjects and only 48.4% of patients produced interferon-alpha ( P =.03). Among the positive samples, however, there were no differences in the interferon-alpha levels between patients and control subjects. In contrast, induction of interferon gamma in response to lipopolysaccharide was similar in control subjects (78.0%) and vulvar vestibulitis patients (82.1%). Women who have a deficiency in interferon-alpha production did not have an increased prevalence of human papillomavirus infection. There was no relation between interleukin-1 receptor antagonist genotype and interferon-alpha production. CONCLUSION: An inability to produce interferon-alpha may contribute to chronic vestibular inflammation in some women.
2002: Gerber Stefan; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
Defective regulation of the proinflammatory immune response in women with vulvar vestibulitis syndrome.
American journal of obstetrics and gynecology 2002;186(4):696-700.
OBJECTIVE: The cause of vulvar vestibulitis syndrome is unknown. To determine a possible role for defective immune regulation in this chronic condition, proinflammatory and anti-inflammatory immune responses to the 70-kd heat shock protein and to lipopolysaccharide were compared in women with and without vulvar vestibulitis syndrome. STUDY DESIGN: Whole blood cultures from 62 women with vulvar vestibulitis syndrome and 48 control subjects were incubated in the presence or absence of 5 microg/mL human recombinant 70-kd heat shock protein or 0.1 ng/mL lipopolysaccharide for 18 hours. The culture supernatants were then assayed for interleukin-1 beta and interleukin-1 receptor antagonist by enzyme-linked immunosorbent assay. RESULTS: Median levels of interleukin-1 beta were higher in response to heat shock protein in cultures from patients with vulvar vestibulitis syndrome (median, 1.07 ng/mL) as opposed to control subjects (median, 0.40 ng/mL; P =.006). Conversely, levels of interleukin-1 receptor antagonist were higher in response to heat shock protein in control subjects (median, 39.21 ng/mL) than in patients (median, 29.25 ng/mL; P =.009). In response to lipopolysaccharide, median levels of interleukin-1 beta were similar in patients (1.00 ng/mL) and control subjects (1.15 ng/mL); median interleukin-1 receptor antagonist concentrations were higher in control subjects (70.0 ng/mL) than in patients (44.3 ng/mL; P <.0001). The ratio of interleukin-1 receptor antagonist to interleukin-1 beta was higher in control subjects than in women with vulvar vestibulitis syndrome in response to both heat shock protein (P =.0002) and lipopolysaccharide (P =.01). In uninduced cultures, interleukin-1 receptor antagonist levels were also higher in control subjects (median, 1.60 ng/mL) than in patients with vulvar vestibulitis syndrome (median, 0.62 ng/mL; P <.0001). CONCLUSION: A relative inability to down-regulate proinflammatory interleukin-1 beta activity by interleukin-1 receptor antagonist may contribute to the pathophysiologic features of vulvar vestibulitis syndrome.
2002: Witkin Steven S; Gerber Stefan; Ledger William J
Differential characterization of women with vulvar vestibulitis syndrome.
American journal of obstetrics and gynecology 2002;187(3):589-94.
OBJECTIVE: We differentiated women with vulvar vestibulitis syndrome into subgroups on the basis of the time of symptom onset, a history of recurrent vulvovaginal candidiasis, and the interleukin-1 receptor antagonist gene polymorphism. STUDY DESIGN: One hundred sixty-two consecutive patients with strictly defined vulvar vestibulitis syndrome were asked to fill out a questionnaire with the assistance of their gynecologist. A buccal sample was collected from each subject for the analysis of interleukin-1 receptor antagonist gene polymorphism; vaginal and vestibular microbial investigations were performed. RESULTS: Symptoms began with the first act of coitus in 20.4% of patients. A history of a recurrent Candida vulvovaginal infection was reported in 42.6% of patients; 25.9% of the patients were positive for the homozygous interleukin-1 receptor antagonist 2,2 genotype. Women with primary vulvar vestibulitis syndrome differed from women with secondary vulvar vestibulitis syndrome; women with primary vulvar vestibulitis syndrome were younger at the time of the onset of the symptoms (23.8 vs 31.2 years, P <.0001) and had never been pregnant (84.8% vs 61.2%, P <.0001). Women with a history of recurrent Candida vulvovaginitis differed from the other subjects by having a higher frequency of constant vestibular pain (40.6% vs 20.4%, P =.005), a vaginal discharge (79.7% vs 45.2%, P <.0001), and dysuria (62.3% vs 29.0%, P =.0001). Women who were homozygous for interleukin-1 receptor antagonist 2,2 genotype had an earlier onset of symptoms (26 years) than did women who were allele 1 homozygotes (31.3 years, P <.05). They also had a shorter duration of symptoms (4.1 vs 5.9 years, P <.05) and a higher frequency of allergy (47.6% vs 23.4%, P =.002). Human papillomavirus in the vaginal vestibule occurred at a greater frequency in women who were homozygous for interleukin-1 receptor antagonist 2,2 genotype. CONCLUSION: Subgroups of women with vulvar vestibulitis syndrome may be differentiated by symptomatic and genetic variables.
2003: Gerber Stefan; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
Interleukin-1beta gene polymorphism in women with vulvar vestibulitis syndrome.
European journal of obstetrics, gynecology, and reproductive biology 2003;107(1):74-7.
OBJECTIVE: The pathogenesis of vulvar vestibulitis syndrome remains unknown but may be related to a localized chronic inflammation. The relation between this syndrome and a polymorphism at position +3953 in the interleukin-1beta gene was examined. Allele 2 of this gene has been associated with increased pro-inflammatory immunity. STUDY DESIGN: Buccal or vestibular swabs from 59 women with strictly defined vulvar vestibulitis and from 48 healthy women were tested by polymerase chain reaction for the presence of two alleles at the +3953 interleukin-1beta locus. RESULTS: Allele 2 of the interleukin-1beta gene was identified in 27 (46%) women with vulvar vestibulitis as opposed to 12 (25%) control women (P=0.03). The interleukin-1beta 1,1 genotype was present in 36 (75%) controls as opposed to 32 (54%) vulvar vestibulitis syndrome patients (P=0.02). All subjects had been previously tested for induced interleukin-1beta production in response to bacterial lipopolysaccharide. In both patients and controls, possession of allele 2 was associated with a small but non-statistically significant increase in induced interleukin-1beta production. CONCLUSION: Allele 2 in the interleukin-1beta gene is more common in women with vulvar vestibulitis syndrome than in other women. Susceptibility to vulvar vestibulitis syndrome might be influenced by carriage of this polymorphism.
2004: Babula Oksana; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
Immunoglobulin E antibodies to seminal fluid in women with vulvar vestibulitis syndrome: relation to onset and timing of symptoms.
American journal of obstetrics and gynecology 2004;190(3):663-7.
OBJECTIVE: Patients with vulvar vestibulitis syndrome and control subjects were tested for evidence of allergy to seminal fluid to differentiate women with a clinical diagnosis of vulvar vestibulitis syndrome into discrete categories. STUDY DESIGN: Plasma samples from 52 women with vulvar vestibulitis syndrome and 43 control subjects were tested for immunoglobulin E antibodies to seminal fluid, total immunoglobulin E, interleukin-4, and interleukin-12 by enzyme-linked immunosorbent assay. Demographic and medical histories were obtained by questionnaire and interview. RESULTS: Sixteen of the patients (30.8%) with vulvar vestibulitis syndrome and 2 control subjects (4.7%) tested positive for immunoglobulin E antiseminal fluid. Symptoms began after sexual intercourse in 43.8% of the women who tested immunoglobulin E positive and 11.1% of the women who tested immunoglobulin E negative (P=.02). Symptom initiation after a yeast infection was reported by 31.3% of the women who tested immunoglobulin E positive and by 2.8% of the women who tested immunoglobulin E negative (P=.008). Other symptom-initiating events were reported by 47.2% of the women who tested immunoglobulin E negative and by none of the women who tested immunoglobulin E positive (P=.0008). Fifty percent of the women who tested immunoglobulin E positive, as opposed to 22.2% of the women who tested immunoglobulin E negative, reported pain only after intercourse (P=.05). Pain at other times occurred in 50% of the women who tested immunoglobulin E positive and in 72.2% of the women who tested immunoglobulin E negative (P=.001). There was no relation between immunoglobulin E antiseminal fluid and total immunoglobulin E, interleukin-4,or interleukin-12. CONCLUSION: A subset of women with vulvar vestibulitis syndrome are sensitized to seminal fluid, and an allergic reaction to seminal fluid may be associated with the initiation and persistence of their symptoms.
2004: Babula Oksana; Danielsson Ingela; Sjoberg Inga; Ledger William J; Witkin Steven S
Altered distribution of mannose-binding lectin alleles at exon I codon 54 in women with vulvar vestibulitis syndrome.
American journal of obstetrics and gynecology 2004;191(3):762-6.
OBJECTIVES: Mannose-binding lectin (MBL) is active in the innate immune defense against microorganisms. In this study, we determined whether vulvar vestibulitis syndrome, a disorder of unknown etiology, was associated with an altered distribution of MBL alleles. STUDY DESIGN: Buccal swabs were obtained from women with vulvar vestibulitis syndrome in New York (62) and from 2 cities in Sweden (60), as well as control women in New York (48) and Sweden (51). DNA was tested for a single nucleotide polymorphism at codon 54 in exon I by polymerase chain reaction, endonuclease digestion, and gel electrophoresis. Blood samples were also obtained from the New York women and tested by ELISA for plasma MBL concentrations. The relationships between genotype, allele frequencies, blood MBL levels, and diagnosis were analyzed by Fisher exact test and one-way analysis of variance. RESULTS: The variant MBL allele, MBL*B, was detected in 35.5% and 26.7% of vulvar vestibulitis patients from New York and Sweden, respectively. Only 12.5% of New York controls (P=.007) and 9.8% of Swedish controls (P=.01) were MBL*2-positive. All women, with one exception, who were positive for MBL*B were MBL*A/MBL*B heterozygotes. Women who carried MBL*B had almost a 10-fold reduction in median plasma MBL concentrations (278 ng/mL), as opposed to women who were MBL*A homozygotes (1980 ng/mL) (P < .0001). CONCLUSION: MBL*B carriage and reduced plasma MBL levels are more common in women with vulvar vestibulitis syndrome than in control patients, and may contribute to symptomatology in a subset of patients.
2006: Bachmann Gloria A; Rosen Raymond; Pinn Vivian W; Utian Wulf H; Ayers Charletta; Basson Rosemary; Binik Yitzchak M; Brown Candace; Foster David C; Gibbons John M; Goldstein Irwin; Graziottin Alessandra; Haefner Hope K; Harlow Bernard L; Spadt Susan Kellogg; Leiblum Sandra R; Masheb Robin M; Reed Barbara D; Sobel Jack D; Veasley Christin; Wesselmann Ursula; Witkin Steven S
Vulvodynia: a state-of-the-art consensus on definitions, diagnosis and management.
The Journal of reproductive medicine 2006;51(6):447-56.
Vulvodynia is a chronic pain syndrome affecting up to 18% of the female population. Despite its high prevalence and associated distress, the etiology, diagnosis and clinical management of the disorder have not been clearly delineated. This "white paper" describes the findings and recommendations of a consensus conference panel based on a comprehensive review of the published literature on vulvodynia in addition to expert presentations on research findings and clinical management approaches. The consensus panel also identified key topics and issues forfurther research, including the role of inflammatory mechanisms and genetic factors and psychosexual contributors.
2008: Babula Oksana; Linhares Iara M; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
Association between primary vulvar vestibulitis syndrome, defective induction of tumor necrosis factor-alpha, and carriage of the mannose-binding lectin codon 54 gene polymorphism.
American journal of obstetrics and gynecology 2008;198(1):101.e1-4.
OBJECTIVE: We evaluated whether women with vulvar vestibulitis syndrome (VVS) could be subdivided on the basis of genotyping the polymorphic mannose-binding lectin (MBL) gene. STUDY DESIGN: DNA from 123 women with VVS was tested for a single nucleotide polymorphism at codon 54 of the MBL gene. Blood samples from 86 of the women were evaluated for ex vivo tumor necrosis factor-alpha (TNF-alpha) and interleukin-1 receptor antagonist (IL-1ra) production in response to Candida albicans, gram-positive peptidoglycan, and gram-negative lipopolysaccharide. Associations between laboratory findings and clinical characteristics were analyzed. RESULTS: The variant MBL*B allele was identified in 33 subjects (26.8%). This polymorphism was more prevalent in women whose symptoms developed at their first act of sexual intercourse (primary VVS, 40.9%), as opposed to women with secondary VVS (16.3%; P = .01). Ex vivo TNF-alpha production, but not IL-1ra production, was reduced in MBL*B carriers as compared with MBL*A homozygotes (P < or = .03). CONCLUSION: The MBL gene polymorphism is associated with the development of primary VVS and a reduced capacity for TNF-alpha production in response to microbial components.
2008: Gerber Stefan; Witkin Steven S; Stucki David
Immunological and genetic characterization of women with vulvodynia.
Journal of medicine and life 2008;1(4):432-8.
Vulvodynia is a complex disorder and described as discomfort or intense burning pain in the vulvar area. Such chronic pain affects 5 to 15% of women and many suffer of misdiagnosis. For sure the aetiology is multifactorial. Through few studies we consider the inflammatory response plays a major role. There is a genetic profile of women suffering of vulvodynia, especially genetic polymorphisms from genes coding for cytokines, Interleukin-1 receptor antagonist and Interleukin-1 beta, and gene coding for mannose-binding lectin (MBL). These polymorphisms result in a stronger inflammatory response and lay these women in a susceptibility situation. Histological analysis showed a chronic no specific inflammation. We have also demonstrated that these patients present in normal state or under infectious induction an inadequate inflammatory response. But there is still a variety of mechanisms which can interact with the inflammatory response. Management of such vulvar pain syndrome could be very frustrating, but the first step for improvement is to get the right diagnosis.
2009: Lev-Sagie Ahinoam; Prus Diana; Linhares Iara M; Lavy Yuval; Ledger William J; Witkin Steven S
Polymorphism in a gene coding for the inflammasome component NALP3 and recurrent vulvovaginal candidiasis in women with vulvar vestibulitis syndrome.
American journal of obstetrics and gynecology 2009;200(3):303.e1-6.
OBJECTIVE: Patients with vulvar vestibulitis syndrome (VVS) and control subjects were tested for a polymorphism in the gene coding for the NALP3 component of inflammasomes, cytoplasmic structures regulating interleukin (IL)-1beta production. STUDY DESIGN: DNA from 143 women with VVS and 182 control women were tested for a length polymorphism in intron 4 of the gene (CIAS1) that codes for NALP3. Vestibular tissue was examined for NALP3 expression. Whole blood cultures were tested for Candida albicans-induced IL-1beta production. RESULTS: The allele 12 frequency was higher in control subjects than in the patients with VVS (P = .02). Among patients with VVS and a self-reported history of recurrent vulvovaginal candidiasis (RVVC), the allele 7 frequency was 43.9% as compared with 30.8% in patients with no history of RVVC and 26.9% in control women (P = .035 vs other patients and .001 vs control subjects). NALP3 was identified in vestibular tissue. C albicans-induced IL-1beta production was reduced in samples from women with the 7,7 genotype (P = .030). CONCLUSION: Polymorphism in the CIAS1 gene may play a central role in the triggering of VVS in a subset of
Received 12 September 2006; received in revised form 2 April 2007; accepted 23 May 2007.
Objective
We evaluated whether women with vulvar vestibulitis syndrome (VVS) could be subdivided on the basis of genotyping the polymorphic mannose-binding lectin (MBL) gene.
Study Design
DNA from 123 women with VVS was tested for a single nucleotide polymorphism at codon 54 of the MBL gene. Blood samples from 86 of the women were evaluated for ex vivo tumor necrosis factor-α (TNF-α) and interleukin-1 receptor antagonist (IL-1ra) production in response to Candida albicans, Gram-positive peptidoglycan, and Gram-negative lipopolysaccharide. Associations between laboratory findings and clinical characteristics were analyzed.
Results
The variant MBL*B allele was identified in 33 subjects (26.8%). This polymorphism was more prevalent in women whose symptoms developed at their first act of sexual intercourse (primary VVS, 40.9%), as opposed to women with secondary VVS (16.3%; P = .01). Ex vivo TNF-α production, but not IL-1ra production, was reduced in MBL*B carriers as compared with MBL*A homozygotes (P ≤ .03).
Conclusion
The MBL gene polymorphism is associated with the development of primary VVS and a reduced capacity for TNF-α production in response to microbial components.
Key words: Candida albicans, genetic polymorphism, mannose-binding lectin, tumor necrosis factor-α, vulvar vestibulitis syndrome
Division of Immunology and Infectious Diseases, Department of Obstetrics and Gynecology, Weill Medical College of Cornell University, New York, NY.
Reprints: Steven S. Witkin, MD, Department of Obstetrics and Gynecology, Weill Medical College of Cornell University, 525 East 68th St, Box 35, New York, NY 10021.
This work was supported in part by a grant from the National Vulvodynia Association.
Cite this article as: Babula O, Linhares IM, Bongiovanni AM, et al. Association between primary vulvar vestibulitis syndrome, defective induction of tumor necrosis factor-α, and carriage of the mannose-binding lectin codon 54 gene polymorphism. Am J Obstet Gynecol 2008;198;101.e1-101.e4.
http://www.ajog.org/article/S0002-9378(07)00676-X/abstract
2003: Gerber Stefan; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
Interleukin-1beta gene polymorphism in women with vulvar vestibulitis syndrome.
European journal of obstetrics, gynecology, and reproductive biology 2003;107(1):74-7.
OBJECTIVE: The pathogenesis of vulvar vestibulitis syndrome remains unknown but may be related to a localized chronic inflammation. The relation between this syndrome and a polymorphism at position +3953 in the interleukin-1beta gene was examined. Allele 2 of this gene has been associated with increased pro-inflammatory immunity. STUDY DESIGN: Buccal or vestibular swabs from 59 women with strictly defined vulvar vestibulitis and from 48 healthy women were tested by polymerase chain reaction for the presence of two alleles at the +3953 interleukin-1beta locus. RESULTS: Allele 2 of the interleukin-1beta gene was identified in 27 (46%) women with vulvar vestibulitis as opposed to 12 (25%) control women (P=0.03). The interleukin-1beta 1,1 genotype was present in 36 (75%) controls as opposed to 32 (54%) vulvar vestibulitis syndrome patients (P=0.02). All subjects had been previously tested for induced interleukin-1beta production in response to bacterial lipopolysaccharide. In both patients and controls, possession of allele 2 was associated with a small but non-statistically significant increase in induced interleukin-1beta production. CONCLUSION: Allele 2 in the interleukin-1beta gene is more common in women with vulvar vestibulitis syndrome than in other women. Susceptibility to vulvar vestibulitis syndrome might be influenced by carriage of this polymorphis
2000: Jeremias J; Ledger W J; Witkin S S
Interleukin 1 receptor antagonist gene polymorphism in women with vulvar vestibulitis.
American journal of obstetrics and gynecology 2000;182(2):283-5.
OBJECTIVE: Vulvar vestibulitis is a chronic inflammatory syndrome of unknown cause and pathogenesis. We examined the relation between vulvar vestibulitis and polymorphisms in the gene coding for the interleukin 1 receptor antagonist, a naturally occurring down-regulator of proinflammatory immune responses. STUDY DESIGN: Cells from the lower genital tract of 68 women with vulvar vestibulitis, 343 women with no history of vulvodynia, and 40 women with human papillomavirus cervical infection were tested by polymerase chain reaction for the different alleles of the gene encoding for interleukin 1 receptor antagonist. The presence of human papillomavirus in the specimens was determined by polymerase chain reaction with the use of degenerate consensus primers to the conserved L1 gene. RESULTS: Allele 2 of the gene encoding the interleukin 1 receptor antagonist was present in homozygous form in 52.9% of women with vulvar vestibulitis. In marked contrast only 8. 5% of the control women and 2.5% of women with human papillomavirus were homozygous for this allele (P
2002: Gerber Stefan; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
A deficiency in interferon-alpha production in women with vulvar vestibulitis.
American journal of obstetrics and gynecology 2002;186(3):361-4.
OBJECTIVE: Previous studies have suggested that interferon-alpha may be an effective treatment for some women with vulvar vestibulitis. We evaluated whether women with this syndrome had a deficiency in endogenous and induced interferon-alpha production. STUDY DESIGN: Blood was collected in heparinized tubes from 62 women with vulvar vestibulitis and 47 control women of similar age and ethnicity. Whole blood cultures were incubated in the presence of 0.1 ng/mL lipopolysaccharide (induced) or culture medium (uninduced) for 18 to 20 hours. Aliquots were tested for interferon-alpha levels by enzyme-linked immunosorbent assay. Vestibular samples were tested for human papillomavirus by polymerase chain reaction. Aliquots were also characterized for alleles of the polymorphic gene, interleukin-1 receptor antagonist, by polymerase chain reaction. RESULTS: In uninduced cultures, interferon-gamma was present in 68.1% of control subjects as opposed to 33.9% of vulvar vestibulitis patients ( P =.0005). Similarly, after lipopolysaccharide stimulation, 70.2% of control subjects and only 48.4% of patients produced interferon-alpha ( P =.03). Among the positive samples, however, there were no differences in the interferon-alpha levels between patients and control subjects. In contrast, induction of interferon gamma in response to lipopolysaccharide was similar in control subjects (78.0%) and vulvar vestibulitis patients (82.1%). Women who have a deficiency in interferon-alpha production did not have an increased prevalence of human papillomavirus infection. There was no relation between interleukin-1 receptor antagonist genotype and interferon-alpha production. CONCLUSION: An inability to produce interferon-alpha may contribute to chronic vestibular inflammation in some women.
2002: Gerber Stefan; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
Defective regulation of the proinflammatory immune response in women with vulvar vestibulitis syndrome.
American journal of obstetrics and gynecology 2002;186(4):696-700.
OBJECTIVE: The cause of vulvar vestibulitis syndrome is unknown. To determine a possible role for defective immune regulation in this chronic condition, proinflammatory and anti-inflammatory immune responses to the 70-kd heat shock protein and to lipopolysaccharide were compared in women with and without vulvar vestibulitis syndrome. STUDY DESIGN: Whole blood cultures from 62 women with vulvar vestibulitis syndrome and 48 control subjects were incubated in the presence or absence of 5 microg/mL human recombinant 70-kd heat shock protein or 0.1 ng/mL lipopolysaccharide for 18 hours. The culture supernatants were then assayed for interleukin-1 beta and interleukin-1 receptor antagonist by enzyme-linked immunosorbent assay. RESULTS: Median levels of interleukin-1 beta were higher in response to heat shock protein in cultures from patients with vulvar vestibulitis syndrome (median, 1.07 ng/mL) as opposed to control subjects (median, 0.40 ng/mL; P =.006). Conversely, levels of interleukin-1 receptor antagonist were higher in response to heat shock protein in control subjects (median, 39.21 ng/mL) than in patients (median, 29.25 ng/mL; P =.009). In response to lipopolysaccharide, median levels of interleukin-1 beta were similar in patients (1.00 ng/mL) and control subjects (1.15 ng/mL); median interleukin-1 receptor antagonist concentrations were higher in control subjects (70.0 ng/mL) than in patients (44.3 ng/mL; P <.0001). The ratio of interleukin-1 receptor antagonist to interleukin-1 beta was higher in control subjects than in women with vulvar vestibulitis syndrome in response to both heat shock protein (P =.0002) and lipopolysaccharide (P =.01). In uninduced cultures, interleukin-1 receptor antagonist levels were also higher in control subjects (median, 1.60 ng/mL) than in patients with vulvar vestibulitis syndrome (median, 0.62 ng/mL; P <.0001). CONCLUSION: A relative inability to down-regulate proinflammatory interleukin-1 beta activity by interleukin-1 receptor antagonist may contribute to the pathophysiologic features of vulvar vestibulitis syndrome.
2002: Witkin Steven S; Gerber Stefan; Ledger William J
Differential characterization of women with vulvar vestibulitis syndrome.
American journal of obstetrics and gynecology 2002;187(3):589-94.
OBJECTIVE: We differentiated women with vulvar vestibulitis syndrome into subgroups on the basis of the time of symptom onset, a history of recurrent vulvovaginal candidiasis, and the interleukin-1 receptor antagonist gene polymorphism. STUDY DESIGN: One hundred sixty-two consecutive patients with strictly defined vulvar vestibulitis syndrome were asked to fill out a questionnaire with the assistance of their gynecologist. A buccal sample was collected from each subject for the analysis of interleukin-1 receptor antagonist gene polymorphism; vaginal and vestibular microbial investigations were performed. RESULTS: Symptoms began with the first act of coitus in 20.4% of patients. A history of a recurrent Candida vulvovaginal infection was reported in 42.6% of patients; 25.9% of the patients were positive for the homozygous interleukin-1 receptor antagonist 2,2 genotype. Women with primary vulvar vestibulitis syndrome differed from women with secondary vulvar vestibulitis syndrome; women with primary vulvar vestibulitis syndrome were younger at the time of the onset of the symptoms (23.8 vs 31.2 years, P <.0001) and had never been pregnant (84.8% vs 61.2%, P <.0001). Women with a history of recurrent Candida vulvovaginitis differed from the other subjects by having a higher frequency of constant vestibular pain (40.6% vs 20.4%, P =.005), a vaginal discharge (79.7% vs 45.2%, P <.0001), and dysuria (62.3% vs 29.0%, P =.0001). Women who were homozygous for interleukin-1 receptor antagonist 2,2 genotype had an earlier onset of symptoms (26 years) than did women who were allele 1 homozygotes (31.3 years, P <.05). They also had a shorter duration of symptoms (4.1 vs 5.9 years, P <.05) and a higher frequency of allergy (47.6% vs 23.4%, P =.002). Human papillomavirus in the vaginal vestibule occurred at a greater frequency in women who were homozygous for interleukin-1 receptor antagonist 2,2 genotype. CONCLUSION: Subgroups of women with vulvar vestibulitis syndrome may be differentiated by symptomatic and genetic variables.
2003: Gerber Stefan; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
Interleukin-1beta gene polymorphism in women with vulvar vestibulitis syndrome.
European journal of obstetrics, gynecology, and reproductive biology 2003;107(1):74-7.
OBJECTIVE: The pathogenesis of vulvar vestibulitis syndrome remains unknown but may be related to a localized chronic inflammation. The relation between this syndrome and a polymorphism at position +3953 in the interleukin-1beta gene was examined. Allele 2 of this gene has been associated with increased pro-inflammatory immunity. STUDY DESIGN: Buccal or vestibular swabs from 59 women with strictly defined vulvar vestibulitis and from 48 healthy women were tested by polymerase chain reaction for the presence of two alleles at the +3953 interleukin-1beta locus. RESULTS: Allele 2 of the interleukin-1beta gene was identified in 27 (46%) women with vulvar vestibulitis as opposed to 12 (25%) control women (P=0.03). The interleukin-1beta 1,1 genotype was present in 36 (75%) controls as opposed to 32 (54%) vulvar vestibulitis syndrome patients (P=0.02). All subjects had been previously tested for induced interleukin-1beta production in response to bacterial lipopolysaccharide. In both patients and controls, possession of allele 2 was associated with a small but non-statistically significant increase in induced interleukin-1beta production. CONCLUSION: Allele 2 in the interleukin-1beta gene is more common in women with vulvar vestibulitis syndrome than in other women. Susceptibility to vulvar vestibulitis syndrome might be influenced by carriage of this polymorphism.
2004: Babula Oksana; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
Immunoglobulin E antibodies to seminal fluid in women with vulvar vestibulitis syndrome: relation to onset and timing of symptoms.
American journal of obstetrics and gynecology 2004;190(3):663-7.
OBJECTIVE: Patients with vulvar vestibulitis syndrome and control subjects were tested for evidence of allergy to seminal fluid to differentiate women with a clinical diagnosis of vulvar vestibulitis syndrome into discrete categories. STUDY DESIGN: Plasma samples from 52 women with vulvar vestibulitis syndrome and 43 control subjects were tested for immunoglobulin E antibodies to seminal fluid, total immunoglobulin E, interleukin-4, and interleukin-12 by enzyme-linked immunosorbent assay. Demographic and medical histories were obtained by questionnaire and interview. RESULTS: Sixteen of the patients (30.8%) with vulvar vestibulitis syndrome and 2 control subjects (4.7%) tested positive for immunoglobulin E antiseminal fluid. Symptoms began after sexual intercourse in 43.8% of the women who tested immunoglobulin E positive and 11.1% of the women who tested immunoglobulin E negative (P=.02). Symptom initiation after a yeast infection was reported by 31.3% of the women who tested immunoglobulin E positive and by 2.8% of the women who tested immunoglobulin E negative (P=.008). Other symptom-initiating events were reported by 47.2% of the women who tested immunoglobulin E negative and by none of the women who tested immunoglobulin E positive (P=.0008). Fifty percent of the women who tested immunoglobulin E positive, as opposed to 22.2% of the women who tested immunoglobulin E negative, reported pain only after intercourse (P=.05). Pain at other times occurred in 50% of the women who tested immunoglobulin E positive and in 72.2% of the women who tested immunoglobulin E negative (P=.001). There was no relation between immunoglobulin E antiseminal fluid and total immunoglobulin E, interleukin-4,or interleukin-12. CONCLUSION: A subset of women with vulvar vestibulitis syndrome are sensitized to seminal fluid, and an allergic reaction to seminal fluid may be associated with the initiation and persistence of their symptoms.
2004: Babula Oksana; Danielsson Ingela; Sjoberg Inga; Ledger William J; Witkin Steven S
Altered distribution of mannose-binding lectin alleles at exon I codon 54 in women with vulvar vestibulitis syndrome.
American journal of obstetrics and gynecology 2004;191(3):762-6.
OBJECTIVES: Mannose-binding lectin (MBL) is active in the innate immune defense against microorganisms. In this study, we determined whether vulvar vestibulitis syndrome, a disorder of unknown etiology, was associated with an altered distribution of MBL alleles. STUDY DESIGN: Buccal swabs were obtained from women with vulvar vestibulitis syndrome in New York (62) and from 2 cities in Sweden (60), as well as control women in New York (48) and Sweden (51). DNA was tested for a single nucleotide polymorphism at codon 54 in exon I by polymerase chain reaction, endonuclease digestion, and gel electrophoresis. Blood samples were also obtained from the New York women and tested by ELISA for plasma MBL concentrations. The relationships between genotype, allele frequencies, blood MBL levels, and diagnosis were analyzed by Fisher exact test and one-way analysis of variance. RESULTS: The variant MBL allele, MBL*B, was detected in 35.5% and 26.7% of vulvar vestibulitis patients from New York and Sweden, respectively. Only 12.5% of New York controls (P=.007) and 9.8% of Swedish controls (P=.01) were MBL*2-positive. All women, with one exception, who were positive for MBL*B were MBL*A/MBL*B heterozygotes. Women who carried MBL*B had almost a 10-fold reduction in median plasma MBL concentrations (278 ng/mL), as opposed to women who were MBL*A homozygotes (1980 ng/mL) (P < .0001). CONCLUSION: MBL*B carriage and reduced plasma MBL levels are more common in women with vulvar vestibulitis syndrome than in control patients, and may contribute to symptomatology in a subset of patients.
2006: Bachmann Gloria A; Rosen Raymond; Pinn Vivian W; Utian Wulf H; Ayers Charletta; Basson Rosemary; Binik Yitzchak M; Brown Candace; Foster David C; Gibbons John M; Goldstein Irwin; Graziottin Alessandra; Haefner Hope K; Harlow Bernard L; Spadt Susan Kellogg; Leiblum Sandra R; Masheb Robin M; Reed Barbara D; Sobel Jack D; Veasley Christin; Wesselmann Ursula; Witkin Steven S
Vulvodynia: a state-of-the-art consensus on definitions, diagnosis and management.
The Journal of reproductive medicine 2006;51(6):447-56.
Vulvodynia is a chronic pain syndrome affecting up to 18% of the female population. Despite its high prevalence and associated distress, the etiology, diagnosis and clinical management of the disorder have not been clearly delineated. This "white paper" describes the findings and recommendations of a consensus conference panel based on a comprehensive review of the published literature on vulvodynia in addition to expert presentations on research findings and clinical management approaches. The consensus panel also identified key topics and issues forfurther research, including the role of inflammatory mechanisms and genetic factors and psychosexual contributors.
2008: Babula Oksana; Linhares Iara M; Bongiovanni Ann Marie; Ledger William J; Witkin Steven S
Association between primary vulvar vestibulitis syndrome, defective induction of tumor necrosis factor-alpha, and carriage of the mannose-binding lectin codon 54 gene polymorphism.
American journal of obstetrics and gynecology 2008;198(1):101.e1-4.
OBJECTIVE: We evaluated whether women with vulvar vestibulitis syndrome (VVS) could be subdivided on the basis of genotyping the polymorphic mannose-binding lectin (MBL) gene. STUDY DESIGN: DNA from 123 women with VVS was tested for a single nucleotide polymorphism at codon 54 of the MBL gene. Blood samples from 86 of the women were evaluated for ex vivo tumor necrosis factor-alpha (TNF-alpha) and interleukin-1 receptor antagonist (IL-1ra) production in response to Candida albicans, gram-positive peptidoglycan, and gram-negative lipopolysaccharide. Associations between laboratory findings and clinical characteristics were analyzed. RESULTS: The variant MBL*B allele was identified in 33 subjects (26.8%). This polymorphism was more prevalent in women whose symptoms developed at their first act of sexual intercourse (primary VVS, 40.9%), as opposed to women with secondary VVS (16.3%; P = .01). Ex vivo TNF-alpha production, but not IL-1ra production, was reduced in MBL*B carriers as compared with MBL*A homozygotes (P < or = .03). CONCLUSION: The MBL gene polymorphism is associated with the development of primary VVS and a reduced capacity for TNF-alpha production in response to microbial components.
2008: Gerber Stefan; Witkin Steven S; Stucki David
Immunological and genetic characterization of women with vulvodynia.
Journal of medicine and life 2008;1(4):432-8.
Vulvodynia is a complex disorder and described as discomfort or intense burning pain in the vulvar area. Such chronic pain affects 5 to 15% of women and many suffer of misdiagnosis. For sure the aetiology is multifactorial. Through few studies we consider the inflammatory response plays a major role. There is a genetic profile of women suffering of vulvodynia, especially genetic polymorphisms from genes coding for cytokines, Interleukin-1 receptor antagonist and Interleukin-1 beta, and gene coding for mannose-binding lectin (MBL). These polymorphisms result in a stronger inflammatory response and lay these women in a susceptibility situation. Histological analysis showed a chronic no specific inflammation. We have also demonstrated that these patients present in normal state or under infectious induction an inadequate inflammatory response. But there is still a variety of mechanisms which can interact with the inflammatory response. Management of such vulvar pain syndrome could be very frustrating, but the first step for improvement is to get the right diagnosis.
2009: Lev-Sagie Ahinoam; Prus Diana; Linhares Iara M; Lavy Yuval; Ledger William J; Witkin Steven S
Polymorphism in a gene coding for the inflammasome component NALP3 and recurrent vulvovaginal candidiasis in women with vulvar vestibulitis syndrome.
American journal of obstetrics and gynecology 2009;200(3):303.e1-6.
OBJECTIVE: Patients with vulvar vestibulitis syndrome (VVS) and control subjects were tested for a polymorphism in the gene coding for the NALP3 component of inflammasomes, cytoplasmic structures regulating interleukin (IL)-1beta production. STUDY DESIGN: DNA from 143 women with VVS and 182 control women were tested for a length polymorphism in intron 4 of the gene (CIAS1) that codes for NALP3. Vestibular tissue was examined for NALP3 expression. Whole blood cultures were tested for Candida albicans-induced IL-1beta production. RESULTS: The allele 12 frequency was higher in control subjects than in the patients with VVS (P = .02). Among patients with VVS and a self-reported history of recurrent vulvovaginal candidiasis (RVVC), the allele 7 frequency was 43.9% as compared with 30.8% in patients with no history of RVVC and 26.9% in control women (P = .035 vs other patients and .001 vs control subjects). NALP3 was identified in vestibular tissue. C albicans-induced IL-1beta production was reduced in samples from women with the 7,7 genotype (P = .030). CONCLUSION: Polymorphism in the CIAS1 gene may play a central role in the triggering of VVS in a subset of
 Aida Blanchett
Aida Blanchett
Elena Tione Presidente VULVODINIA.INFO ONLUS
 Qualifica professionale :
Qualifica professionale :
Mind-Body Health Coach per donne con dolore pelvico
Esci dal dolore ed Entra nella Tua Vita (c)!
Scopri come dire addio al tuo dolore pelvico
www.aidablanchett.com/mindbodynews
Instagram
www.instagram.com/elenationehealthylifecoach
Messaggi : 16107
Iscritto il : 17.10.10
Anno di nascita : 1977
Provincia di residenza : Roma
Comune : Roma Storia personale : • LA MIA STORIA e la fondazione di VULVODINIA.INFO e VULVODINIA.INFO ONLUS
Storia personale : • LA MIA STORIA e la fondazione di VULVODINIA.INFO e VULVODINIA.INFO ONLUS

Anche quest'anno non dimenticarti delle oltre 4 milioni di italiane che soffrono di vulvodinia!
Il tuo 5 per Mille per 1 donna su 7 Codice Fiscale 97 82 56 90 585
• Non sono un medico.
Tutti i consigli vanno seguiti sotto la propria respons-abilità e valutati col proprio medico curante, al quale nessuno senza gli stessi titoli e autorizzazioni può legalmente ed eticamente sostituirsi.
.
VULVODINIA.INFO ONLUS non è e non può essere ritenuto in alcun modo responsabile dei contenuti dei messaggi presenti nel Forum, scritti e inviati autonomamente dagli Utenti sotto loro piena e totale respons-abilità.
.
VULVODINIA.INFO ONLUS si riserva la facoltà, a suo insindacabile giudizio, di eliminare/modificare dal Forum i post aventi contenuto illegittimo, illegale o comunque lesivo di altrui diritti e dei contenuti ritenuti non in linea con il Regolamento completo e aggiornato della comunità.
.
I gestori di VULVODINIA.INFO ONLUS non si assumono in alcun modo alcuna respons-abilità per eventuali danni derivati a persone e cose tramite i messaggi inseriti nel Forum.
 Re: Correlazione MBL (Mannose Binding Lectine) - Vulvodinia • VULVODINIA.INFO
Re: Correlazione MBL (Mannose Binding Lectine) - Vulvodinia • VULVODINIA.INFO
Mar 02 Nov 2010, 20:59
Mannose-binding Lectin (MBL)
I. Introduction and Structure

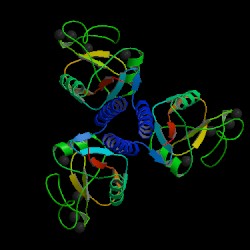
Fig. 1a MBL subunit
Source: Protein Data Bank, 2006
Fig. 2 MBL trimer
Source: Protein Data Bank, 2006
Fig. 1b JMOL image of MBL subunit
Source: Protein Data Bank, 2006 [la vedete quahttp://www.bio.davidson.edu/courses/immunology/Students/spring2006/Mohr/MBL.html]
II. Overview of the Complement System

1. Opsonisation: C3b and, to a lesser degree, C4b molecules are opsonins. They coat foreign organisms, greatly enhancing their phagocytosis because phagocytes have receptors that recognize complement proteins bound to pathogen.
2. Inflammation: The C5a and, less potently, the C4a and C3a fragments are important inflammatory activators inducing vascular permeability, recruitment and activation of phagocytes.
Complement proteins start to be made in the first trimester of fetal development, and are an important part of innate immunity (Sompayrac, 1999). Although the innate immune system is not as specific as adaptive immunity, it can distinguish self from nonself via receptors that recognize patterns of repeating structural motifs on the surface of microorganisms. Pathogens have surface sugars, like mannose, which are absent from mammalian cell surfaces. MBL is an example of a pattern-recognition receptor present as a free protein in blood plasma. MBL binds to bacterial surfaces that display a particular spatial arrangement of carbohydrate sugar residues, mannose or fructose (Janeway et al., 2005).
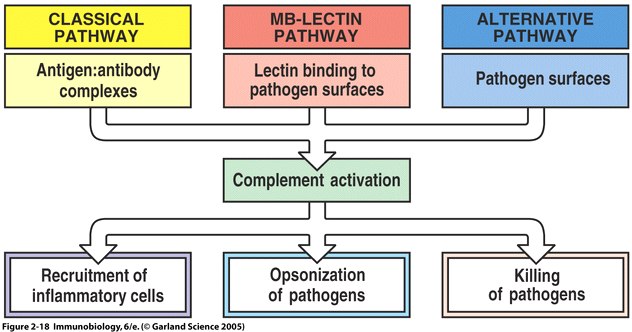
Fig. 3 MBL recognizes bacterial surfaces by their particular spacing of carbohydrate residues (Fig. 2.11 from Janeway et al. , 2005).
Once MBL recognizes a pathogen, its lectin domain will bind to mannose, or other carbohyrate sugar residues on the pathogen surface, and activate complement via the MB-lectin pathway ( Fig. 2.18 from Janeway et al. , 2005 ).
III. The Function of MBL in the Lectin Pathway
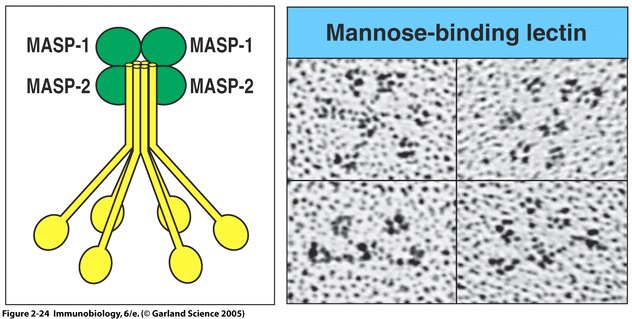
Fig. 5 MBL forms a complex with serine proteases .
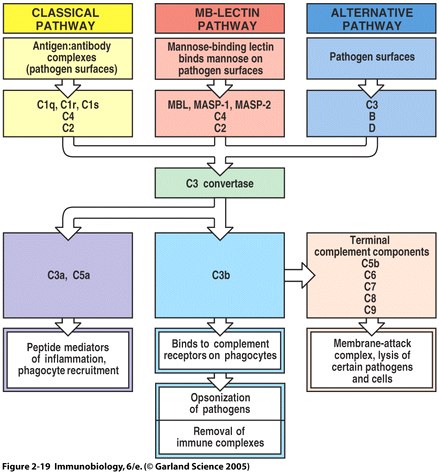
Fig. 6 Overview of the main components and effector actions of complement
IV. Diseases Associated with Mutations in MBL
V. Therapy for MBL Deficiency
VI. Drug Interactions
No interactions between MBL and drugs were listed in OMIM.
VI. References
Anders, Koch et.al. (2001) Acute Respiratory Tract Infections and Mannose-Binding Lectin Insufficiency During Early Childhood. JAMA. 285:1316-1321.
Bouwman, Lee et. al. (2003) Mannose Binding Lectin Gene Poymorphisms Confer a Major Risk for Severe Infections After Liver Transplantation. Gastroenterology. 129 (2): 408-414.
Garred, et. al. (2002) MBL therapy in an MBL-deficient patient with severe cystic fibrosis lung disease. Pediatric Pumonology. 33 (3):2001-2007.
Flemming et.al. (2004) Disease-associated Mutations in Human Mannose-binding Lectin Compromise Oligomerization and Activity of the Final Protein. Journal of Biological Chemistry. 279: 21302-21311.
Jacobsen, S et. al. (2001)The Influence of mannose binding lectin polymorphisms on disease outcome in early polyarthritis. Journal of Rheumatology. 28(5): 935-42.
Janeway, et. al. Immunobiology. Garland Science: New York, NY. 2005. 50-61.
Matsushita, Misao et al. (2000) Proteolytic Activities of Two Types of Mannose-Binding Lectin-Associated Serine Protease. The Journal of Immunology.165: 2637-2642.
Ohlenschlaeger, T. et. al. (2004) Mannose-binding lectin variant alleles and the risk of arterial thrombosis in systemic lupus erythematosus. New Eng. J. Med. 351: 260-267.
OMIM: www.ncbi.nlm.nih.gov/omim/ . Accessed on March 10, 2006.
Protein Data Bank Accessed on March 13, 2006.
Sompayrac, Lauren. How the Immune System Works . Blackwell Science: Malden, MA. 1999. 17-19.
Suankratay, M. et. al. (1999) Mechanism of complement-dependent haemolysis via the lectin pathway: role of the complement regulatory proteins. Clinical and Experimental Immunology. 117: 442.M
Summerfiled, JA., Clinical potential of mannose-binding lectin-replacement therapy. Biochemisty Society Transactions. Aug. 2003: 770-3.
Summerfield, et.al. (1997) Association of mutations in mannose binding protein gene with childhood infection in consecutive hospital series. Brittish Medical Journal 314: 1229-1231.
Trevisiol, C. (2005) MBL2 polymorphisms screening in a regional Italian CF Center. Journal of Cyctic Fibrosis. 4(3): 189-91.
Turner, M. W. (1991) Deficiency of mannan binding protein--a new complement deficiency syndrome. Clin. Exp. Immunology. 86: 53-56.
Turner, M.W . (1998) Mannose-binding lectin (MBL) in health and disease. Immunobiology. 199 (2): 327-39
I. Introduction and Structure
Mannose-binding lectin (MBL), also called mannose binding protein (MBP), is a calcium-dependent serum protein that plays a role in the innate immune response by binding to carbohydrates on the surface of a wide range of pathogens (viruses, bacteria, fungi, protozoa ) where it can activate the complement system or act directly as an opsonin (Anders, 2001). Mannose-binding lectin is a member of the collectin family of proteins, which are made in the liver and can opsonize bacteria by tagging the surface of a pathogen to facilitate recognition and ingestion by phagocytes. Collectins get their name because they have a collagen-like region and a lectin region. Lectins are proteins that bind sugar molecules, usually on the surface of bacteria. The collagen domain interacts with the effector parts of the innate immune system. The MBL2 gene on human chromosome 10 produces MBL, an oligomer of 248-amino acid protein subunits composed of three identical polypeptide chains comprising a cistine rich region, a collagen-like region, a neck, and a carbohydrate recognition domain (Matsushita, et al, 2000). Three MBL polypeptide chains assemble into a biologically active trimer found in vivo.


Fig. 1a MBL subunit
Source: Protein Data Bank, 2006
Fig. 2 MBL trimer
Source: Protein Data Bank, 2006
Fig. 1b JMOL image of MBL subunit
Source: Protein Data Bank, 2006 [la vedete quahttp://www.bio.davidson.edu/courses/immunology/Students/spring2006/Mohr/MBL.html]
II. Overview of the Complement System
The complement system is a set of plasma proteins that work together to attack extracelluar pathogens. While the most important role of the complement system is to opsonize pathogens, it also recruits inflammatory cells and kills pathogens directly through membrane attack complexes. The complement system can be activated through three pathways: the classical pathway, the alternative pathway, and the mannose-binding (MB) lectin pathway (see Fig 4 below).
One of the biggest obstacles to making sense of the complement system is understanding the nomenclature of the proteins involved. All components of the classical complement pathway and membrane attack complex are designated by the letter C followed by a number. What is confusing is that the components were numbered in order of their discovery rather than the sequence of reactions. The reaction sequence is C1, C4, C3, C5, C6, C7, C8, and C9. The product of each cleavage reaction are designated by added lower case letters, the larger fragment is called ‘b’ (a helpful mnemonic is ‘b’ stands for big) and a smaller fragment called ‘a.’ The three complement pathways follow a different sequence of “early” cleavage reactions that all lead to the assembly of a protease named C3 convertase. C3 is a protein involved in complement which is cleaved by the C3 convertase into two fragments, C3a and C3b. C3a is a mediator of inflammation while C3b covalently binds to the pathogen surface, coating it and acting as an opsonin. The major proteins involved in complement can be summarized according to their function: (Janeway et. al., 2005)
One of the biggest obstacles to making sense of the complement system is understanding the nomenclature of the proteins involved. All components of the classical complement pathway and membrane attack complex are designated by the letter C followed by a number. What is confusing is that the components were numbered in order of their discovery rather than the sequence of reactions. The reaction sequence is C1, C4, C3, C5, C6, C7, C8, and C9. The product of each cleavage reaction are designated by added lower case letters, the larger fragment is called ‘b’ (a helpful mnemonic is ‘b’ stands for big) and a smaller fragment called ‘a.’ The three complement pathways follow a different sequence of “early” cleavage reactions that all lead to the assembly of a protease named C3 convertase. C3 is a protein involved in complement which is cleaved by the C3 convertase into two fragments, C3a and C3b. C3a is a mediator of inflammation while C3b covalently binds to the pathogen surface, coating it and acting as an opsonin. The major proteins involved in complement can be summarized according to their function: (Janeway et. al., 2005)

1. Opsonisation: C3b and, to a lesser degree, C4b molecules are opsonins. They coat foreign organisms, greatly enhancing their phagocytosis because phagocytes have receptors that recognize complement proteins bound to pathogen.
2. Inflammation: The C5a and, less potently, the C4a and C3a fragments are important inflammatory activators inducing vascular permeability, recruitment and activation of phagocytes.
3. Lysis: C5b binds and recruits C6 and C7 to the target surface. C7 and subsequently C8 change conformation to expose hydrophobic domains which insert in the lipid bilayer. The C5b678 complex catalyses the polymerisation of the final component C9 which forms a transmembrane pore of ~ 10nm diameter causing lysis of the cell. This macromolecular assembly is known as theMembrane Attack Complex (MAC).
4. Immune complex clearance: Complement has a very important role in solubilising and causing removal from the circulation of immune complexes. It does this by the binding of C4b and C3b, covalently bound to the immune complex, to CR1 complement receptors on red blood cells which transport the complexes to the liver and spleen where they give the complexes up to phagocytes for destruction.
Complement proteins start to be made in the first trimester of fetal development, and are an important part of innate immunity (Sompayrac, 1999). Although the innate immune system is not as specific as adaptive immunity, it can distinguish self from nonself via receptors that recognize patterns of repeating structural motifs on the surface of microorganisms. Pathogens have surface sugars, like mannose, which are absent from mammalian cell surfaces. MBL is an example of a pattern-recognition receptor present as a free protein in blood plasma. MBL binds to bacterial surfaces that display a particular spatial arrangement of carbohydrate sugar residues, mannose or fructose (Janeway et al., 2005).

Fig. 3 MBL recognizes bacterial surfaces by their particular spacing of carbohydrate residues (Fig. 2.11 from Janeway et al. , 2005)
Fig 4 The main fuctions of complement are recruitment of inflammatory cells, opsonization of pathogens, and killing of pathogens
Once MBL recognizes a pathogen, its lectin domain will bind to mannose, or other carbohyrate sugar residues on the pathogen surface, and activate complement via the MB-lectin pathway ( Fig. 2.18 from Janeway et al. , 2005 ).
III. The Function of MBL in the Lectin Pathway
The complement system can be activated through three pathways: the classical pathway, the alternative pathway, and the mannose-binding (MB) lectin pathway (see Fig 4 above). The most-recently discovered mannose-binding lectin pathway activates complement through the mannose-binding lectin protein. MBL binds to carbohydrates found on the surface of many pathogens. For example, MBL has been show to bind to yeasts such as Candida albicans , to viruses such as HIV and influenza A, to many bacteria including Salmonella and Streptococci , and to parasites like Leishmania (Sompayrac, 1999).
In order to active the complement system, MBL in the blood complexes with (binds to) another protein, a serine protease called MASPs (MBL-associated serine proteases). When MBL binds to its target (for example, mannose on the surface of a bacterium), the MASP protein functions like a convertase to clip C3 into C3a and C3b. C3 is abundant in the blood, so this happens very efficiently. The C3b fragments can then bind to the surface of the bacterium. C3b can cause the complement cascade can proceed in combining with other complement proteins to make a membrane attack complex, which causes lysis of pathogens and cells. C3b can also bind to complement receptors on phagocytes causing opsonization of pathogens (Somapayrac, 1999).

Fig. 5 MBL forms a complex with serine proteases .
Right panel: MBL forms clusters of two to six carbohydrate-binding heads around a central collagen-like stalk and complexes with MBL-associated serine proteases 1 (MASP-1) and 2 (MAPS-2). On binding of MBL to bacterial surfaces, these serine proteases become activated and can then activate the complement system by cleaving and activating C4 and C2. Left Panel: Electron microscope photograph of a MBL cluster. The structure has been described as looking like a bunch of tulips. The central collagen-like stalk is the flower stem and the MBL head is the flower. ( Fig. 2.24 from Janeway et al. , 2005).

Fig. 6 Overview of the main components and effector actions of complement
Note that the MBL pathway involves the MBL protein, MASP-1, MASP-2, C4, and C2. MASP acts as a C3 convertase, creating a C3b fragment from C3. C3b attaches to the pathogen surface and binds to receptors on phagocytes leading to opsonization. C3b can also combine with other proteins on the pathogen surface and form a membrane attack complex ( Fig. 2.19 from Janeway et al. , 2005 ).
IV. Diseases Associated with Mutations in MBL
The MBL2 gene encodes mannose-binding lectin (MBL) that is secreted by the liver into the bloodstream (Ohlenschlaeger et al., 2004). Although serum levels of MBL are normally rather low (1500 micrograms/litre), MBL has a crucial role in innate immunity (Turner, 1998). The frequency of this deficiency due to mutations of the MBL2 gene in the general population has been estimated to be between 5 and 10% ( Turner, 1991 ). MBL deficiency arising from mutations and promoter polymorphisms in the MBL2 has been associated with increased risk, severity, and frequency of infections and autoimmunity (Flemming, et. al., 2004).
Although most individuals with MBL deficiency are healthy, they have an increased susceptibility to certain illnesses. The deficiency has been reported to be particularly common in infants with recurrent respiratory tract infection, otitis media, and chronic diarrhea. The low levels of MBL in young children with recurrent infections suggest that the MB-lectin pathway is important during the interval between the loss of passively acquired maternal antibody and the acquisition of a mature immunologic repertoire (Summerfield et al., 1997).
MBL deficiency is also associated with non-infectious diseases in adults including systemic lupus erythematosus, rheumatoid arthritis, cystic fibrosis and common variable immunodeficiency. MBL deficiency increases susceptibility to infectious disease. One study that found a significantly higher number of HIV-infected homosexual males were homozygous for variant MBL2 alleles than were high-risk homosexual controls or healthy controls. Although no significant association was found in progression from infection to clinical AIDS, there was a significantly shorter mean survival time after AIDS diagnosis in men carrying variant MBL2 alleles and those with low serum MBL. The increased risks may be associated with increased susceptibility to coinfections (Garred et.al, 1997). MBL-deficiency also poses a problem for other immuno-compromised individuals, such as cancer patients undergoing chemotherapy. In these patients, there was a strong correlation between MBL-deficiency and the occurrence of clinically significant infections. In addition, studies of cystic fibrosis patients found that MBL-deficient patients have a life expectancy 8-years shorter than MBL sufficient individuals, due to increased bacterial colonization of the lung (Trevisiol, 2005).
If MBL is involved in clearing away bacteria and other pathogens, why is MBL deficiency associated with autoimmune diseases such as lupus and rheumatoid arthritis? The immune system has redundant pathways that all have the same function so that if one is not working well, the immune system can still operate. For example, the classical, MB-lectin, and alternative pathway all make a C3 convertase which leads to oposinzation of pathogens, recruitment of inflammatory cells, and killing of pathogens (see Fig. 4). If the MB-lectin pathway is not working well due to MBL deficiency, the immune system compensates by increasing activation via the other pathways. Most notable is the increase in antibody concentration, used in the classical pathway. Studies have shown an increase in serum levels of IgM antibody concentrations in MBL deficient patients with rheumatoid arthritis. The more antibody, the higher the chance that some antibody will be self-reactive, which is what happens in arthritis( Jacobsen, 2001).
It is also interesting to note the effect of MBL gene polymorphisms on the susceptibility to infection after liver transplantation because all MBL is hepatically produced. Infection is the primary cause of death after liver transplantation. As transplant patients require immune suppressive drugs in order to insure graft survival, they rely to a great extent on their innate immunity to counteract infections. Studies show the presence of MBL variant alleles in the MBL gene of the donor liver, but not in the recipient, is associated with a strongly increased incidence of clinically significant infections following transplantation in a gene-dose-dependent way. This confirms that serum MBL is produced by the liver and is under strong genetic control. The ability to identify a group of patients severely prone to infection post transplantation is of significant clinical value. In an era of donor supply, donor selection based upon MBL genotype is inconceivable. Patients receiving an MBL-variant liver could benefit from MBL replacement therapy similar to that presently being studied in phase I/II and III clinical studies (Bouwman, 2003).
V. Therapy for MBL Deficiency
MBL therapy is an area of current research. Therapy for MBL deficient patients involves giving an intravenous infusion of purified mannose-binding lectin obtained from human donor plasma in an attempt to prevent or ameliorate infections. MBL therapy could be used in three clinical scenarios. Firstly, where MBL deficiency leads to increased susceptibility to disease, MBL replacement could be used to increase resistance to that disease. Secondly, in an acute infection MBL therapy might, by enhancing the immune response, speed the resolution of disease in MBL-deficient patients. However, by analogy with complement deficiencies, a potential hazard of MBL replacement in infection is that it might actually do more harm than good by increasing complement-mediated host damage. Uncontrolled activation of the complement system through the MBL pathway may cause inflammation resulting in tissue damage. Thirdly, MBL therapy could be used to alter the natural history of chronic diseases (Summerfiled, 2003).
The usefulness of replacement MBL therapy has shown promise in enhancing recovery to bacterial disease. It will take many years and larger numbers of patients to detect significant changes in the natural history of MBL deficiency associated chronic diseases like rheumatoid arthritis. One study followed a cystic fibrosis patient given MBL pooled from human plasma as an intravenous infusion twice a week for a period of 3 months. The patients's clinical condition was stabilized during the treatment period, but was not improved(Garred, et. al, 2002). Future study of MBL therapy should provide more definitive answers to the effectiveness of short-term and long-term therapy.
VI. Drug Interactions
No interactions between MBL and drugs were listed in OMIM.
VI. References
Anders, Koch et.al. (2001) Acute Respiratory Tract Infections and Mannose-Binding Lectin Insufficiency During Early Childhood. JAMA. 285:1316-1321.
Bouwman, Lee et. al. (2003) Mannose Binding Lectin Gene Poymorphisms Confer a Major Risk for Severe Infections After Liver Transplantation. Gastroenterology. 129 (2): 408-414.
Garred, et. al. (2002) MBL therapy in an MBL-deficient patient with severe cystic fibrosis lung disease. Pediatric Pumonology. 33 (3):2001-2007.
Flemming et.al. (2004) Disease-associated Mutations in Human Mannose-binding Lectin Compromise Oligomerization and Activity of the Final Protein. Journal of Biological Chemistry. 279: 21302-21311.
Jacobsen, S et. al. (2001)The Influence of mannose binding lectin polymorphisms on disease outcome in early polyarthritis. Journal of Rheumatology. 28(5): 935-42.
Janeway, et. al. Immunobiology. Garland Science: New York, NY. 2005. 50-61.
Matsushita, Misao et al. (2000) Proteolytic Activities of Two Types of Mannose-Binding Lectin-Associated Serine Protease. The Journal of Immunology.165: 2637-2642.
Ohlenschlaeger, T. et. al. (2004) Mannose-binding lectin variant alleles and the risk of arterial thrombosis in systemic lupus erythematosus. New Eng. J. Med. 351: 260-267.
OMIM: www.ncbi.nlm.nih.gov/omim/ . Accessed on March 10, 2006.
Protein Data Bank Accessed on March 13, 2006.
Sompayrac, Lauren. How the Immune System Works . Blackwell Science: Malden, MA. 1999. 17-19.
Suankratay, M. et. al. (1999) Mechanism of complement-dependent haemolysis via the lectin pathway: role of the complement regulatory proteins. Clinical and Experimental Immunology. 117: 442.M
Summerfiled, JA., Clinical potential of mannose-binding lectin-replacement therapy. Biochemisty Society Transactions. Aug. 2003: 770-3.
Summerfield, et.al. (1997) Association of mutations in mannose binding protein gene with childhood infection in consecutive hospital series. Brittish Medical Journal 314: 1229-1231.
Trevisiol, C. (2005) MBL2 polymorphisms screening in a regional Italian CF Center. Journal of Cyctic Fibrosis. 4(3): 189-91.
Turner, M. W. (1991) Deficiency of mannan binding protein--a new complement deficiency syndrome. Clin. Exp. Immunology. 86: 53-56.
Turner, M.W . (1998) Mannose-binding lectin (MBL) in health and disease. Immunobiology. 199 (2): 327-39
 Aida Blanchett
Aida Blanchett
Elena Tione Presidente VULVODINIA.INFO ONLUS
 Qualifica professionale :
Qualifica professionale :
Mind-Body Health Coach per donne con dolore pelvico
Esci dal dolore ed Entra nella Tua Vita (c)!
Scopri come dire addio al tuo dolore pelvico
www.aidablanchett.com/mindbodynews
Instagram
www.instagram.com/elenationehealthylifecoach
Messaggi : 16107
Iscritto il : 17.10.10
Anno di nascita : 1977
Provincia di residenza : Roma
Comune : Roma Storia personale : • LA MIA STORIA e la fondazione di VULVODINIA.INFO e VULVODINIA.INFO ONLUS
Storia personale : • LA MIA STORIA e la fondazione di VULVODINIA.INFO e VULVODINIA.INFO ONLUS

Anche quest'anno non dimenticarti delle oltre 4 milioni di italiane che soffrono di vulvodinia!
Il tuo 5 per Mille per 1 donna su 7 Codice Fiscale 97 82 56 90 585
• Non sono un medico.
Tutti i consigli vanno seguiti sotto la propria respons-abilità e valutati col proprio medico curante, al quale nessuno senza gli stessi titoli e autorizzazioni può legalmente ed eticamente sostituirsi.
.
VULVODINIA.INFO ONLUS non è e non può essere ritenuto in alcun modo responsabile dei contenuti dei messaggi presenti nel Forum, scritti e inviati autonomamente dagli Utenti sotto loro piena e totale respons-abilità.
.
VULVODINIA.INFO ONLUS si riserva la facoltà, a suo insindacabile giudizio, di eliminare/modificare dal Forum i post aventi contenuto illegittimo, illegale o comunque lesivo di altrui diritti e dei contenuti ritenuti non in linea con il Regolamento completo e aggiornato della comunità.
.
I gestori di VULVODINIA.INFO ONLUS non si assumono in alcun modo alcuna respons-abilità per eventuali danni derivati a persone e cose tramite i messaggi inseriti nel Forum.
 Re: Correlazione MBL (Mannose Binding Lectine) - Vulvodinia • VULVODINIA.INFO
Re: Correlazione MBL (Mannose Binding Lectine) - Vulvodinia • VULVODINIA.INFO
Mar 02 Nov 2010, 20:59
Analisi della variabilità genetica al locus Mannose binding lectin (MBL) e studi di associazione genotipo/fenotipo contro la Brucella melitensis nella specie caprina
Mancusi, Andrea (2009) Analisi della variabilità genetica al locus Mannose binding lectin (MBL) e studi di associazione genotipo/fenotipo contro la Brucella melitensis nella specie caprina. Dottorato thesis, Università degli Studi di Napoli Federico II.
Full text disponibile come:
PDF - Richiede un editor Pdf del tipo GSview, Xpdf o Adobe Acrobat Reader
1057Kb http://eprints.unifi.it/archive/00000840/14/Cap-3_3.pdf
Abstract
Il gene MBL codifica per una proteina (Mannose Binding Lectin) che ha una funzione determinante nel sistema del complemento. Tale proteina lega specificamente residui di mannosio, fucosio e di altri zuccheri presenti sulle superfici cellulari di patogeni, ma assenti nei vertebrati. In questo modo la MBL è in grado di discriminare il tipo di membrana di attacco e innescare l'attivazione del complemento esclusivamente sulla superficie del patogeno. Lo scopo della presente ricerca è stato lo studio della variabilità genetica al locus MBL nella specie caprina finalizzata all’individuazione di marcatori utili per studi di associazioni alla resistenza nei confronti della Brucella melitensis. Per 3 capre appartenenti ad una popolazione locale allevata in provincia di Catanzaro, è stato sequenziato il gene MBL dal 1° nucleotide del 1° esone al 417° nt del 4° esone per un totale di 3538 bp più 978 basi della regione 5’ UT. Tale gene è organizzato in 4 esoni e 3 introni. L’ORF (Open Reading Frame) codifica per 249 residui aminoacidici, mentre il peptide leader è costituito da 19 aminoacidi. Dal confronto tra le sequenze ottenute dai tre soggetti esaminati sono stati evidenziati un totale di 12 SNP. Al fine di effettuare una genotipizzazione e verificare se esista o meno un’associazione tra tali SNP e la resistenza alla Brucella melitensis sono state scelte 5 delle 12 mutazioni individuate. Delle 5 mutazioni, 4 (G→A-892, C→A-62, G→A116ex2, T→G190int2) sono strettamente associate (fase cis) e, quindi, possono essere considerate come un unico locus biallelico: A e B. La mutazione G→A-802 è stata esclusa in quanto presente con bassa frequenza nella popolazione esaminata. Il fenotipo per ciascun soggetto in esame è stato ottenuto attraverso la determinazione dell’attività antimicrobica verso la Brucella melitensis in vitro, sulla base della differenza tra il valore logaritmico ottenuto dalla conta delle colonie sviluppatesi su una piastra contenente siero sottoposto a trattamento termico per disattivare le proteine del sistema del complemento (siero non attivo) ed una contenente siero non sottoposto a trattamento (siero attivo). I dati ottenuti su un totale di 218 sieri individuali di capra vanno da un minimo di 0,01, che indica la massima suscettibilità al patogeno ad un valore di 1,47 che rappresenta, invece, la massima resistenza. Per la realizzazione della correlazione sono state create due classi fenotipiche (0,01 a 0,74 e 0,75 a 1,47) e sono stati presi in i tre genotipi: AA, AB e BB. Successivamente, è stato calcolato il valore dell’odds ratio che permette di verificare una eventuale associazione tra genotipo e resistenza alla Brucella melitensis. Il calcolo dell’odds ratio (OR) mostra per tale ipotesi un valore pari a 0,51 per il genotipo BB vs quelli non-BB (AA + AB), con limiti di confidenza al 95% compresi tra 0,11 e 2,34. Un tale valore di OR potrebbe far ipotizzare che un individuo omozigote BB abbia una resistenza circa 2 volte superiore rispetto ai soggetti con genotipo AA e AB alla brucellosi
.Mancusi, Andrea (2009) Analisi della variabilità genetica al locus Mannose binding lectin (MBL) e studi di associazione genotipo/fenotipo contro la Brucella melitensis nella specie caprina. Dottorato thesis, Università degli Studi di Napoli Federico II.
Full text disponibile come:
PDF - Richiede un editor Pdf del tipo GSview, Xpdf o Adobe Acrobat Reader
1057Kb http://eprints.unifi.it/archive/00000840/14/Cap-3_3.pdf
Abstract
Il gene MBL codifica per una proteina (Mannose Binding Lectin) che ha una funzione determinante nel sistema del complemento. Tale proteina lega specificamente residui di mannosio, fucosio e di altri zuccheri presenti sulle superfici cellulari di patogeni, ma assenti nei vertebrati. In questo modo la MBL è in grado di discriminare il tipo di membrana di attacco e innescare l'attivazione del complemento esclusivamente sulla superficie del patogeno. Lo scopo della presente ricerca è stato lo studio della variabilità genetica al locus MBL nella specie caprina finalizzata all’individuazione di marcatori utili per studi di associazioni alla resistenza nei confronti della Brucella melitensis. Per 3 capre appartenenti ad una popolazione locale allevata in provincia di Catanzaro, è stato sequenziato il gene MBL dal 1° nucleotide del 1° esone al 417° nt del 4° esone per un totale di 3538 bp più 978 basi della regione 5’ UT. Tale gene è organizzato in 4 esoni e 3 introni. L’ORF (Open Reading Frame) codifica per 249 residui aminoacidici, mentre il peptide leader è costituito da 19 aminoacidi. Dal confronto tra le sequenze ottenute dai tre soggetti esaminati sono stati evidenziati un totale di 12 SNP. Al fine di effettuare una genotipizzazione e verificare se esista o meno un’associazione tra tali SNP e la resistenza alla Brucella melitensis sono state scelte 5 delle 12 mutazioni individuate. Delle 5 mutazioni, 4 (G→A-892, C→A-62, G→A116ex2, T→G190int2) sono strettamente associate (fase cis) e, quindi, possono essere considerate come un unico locus biallelico: A e B. La mutazione G→A-802 è stata esclusa in quanto presente con bassa frequenza nella popolazione esaminata. Il fenotipo per ciascun soggetto in esame è stato ottenuto attraverso la determinazione dell’attività antimicrobica verso la Brucella melitensis in vitro, sulla base della differenza tra il valore logaritmico ottenuto dalla conta delle colonie sviluppatesi su una piastra contenente siero sottoposto a trattamento termico per disattivare le proteine del sistema del complemento (siero non attivo) ed una contenente siero non sottoposto a trattamento (siero attivo). I dati ottenuti su un totale di 218 sieri individuali di capra vanno da un minimo di 0,01, che indica la massima suscettibilità al patogeno ad un valore di 1,47 che rappresenta, invece, la massima resistenza. Per la realizzazione della correlazione sono state create due classi fenotipiche (0,01 a 0,74 e 0,75 a 1,47) e sono stati presi in i tre genotipi: AA, AB e BB. Successivamente, è stato calcolato il valore dell’odds ratio che permette di verificare una eventuale associazione tra genotipo e resistenza alla Brucella melitensis. Il calcolo dell’odds ratio (OR) mostra per tale ipotesi un valore pari a 0,51 per il genotipo BB vs quelli non-BB (AA + AB), con limiti di confidenza al 95% compresi tra 0,11 e 2,34. Un tale valore di OR potrebbe far ipotizzare che un individuo omozigote BB abbia una resistenza circa 2 volte superiore rispetto ai soggetti con genotipo AA e AB alla brucellosi
 Aida Blanchett
Aida Blanchett
Elena Tione Presidente VULVODINIA.INFO ONLUS
 Qualifica professionale :
Qualifica professionale :
Mind-Body Health Coach per donne con dolore pelvico
Esci dal dolore ed Entra nella Tua Vita (c)!
Scopri come dire addio al tuo dolore pelvico
www.aidablanchett.com/mindbodynews
Instagram
www.instagram.com/elenationehealthylifecoach
Messaggi : 16107
Iscritto il : 17.10.10
Anno di nascita : 1977
Provincia di residenza : Roma
Comune : Roma Storia personale : • LA MIA STORIA e la fondazione di VULVODINIA.INFO e VULVODINIA.INFO ONLUS
Storia personale : • LA MIA STORIA e la fondazione di VULVODINIA.INFO e VULVODINIA.INFO ONLUS

Anche quest'anno non dimenticarti delle oltre 4 milioni di italiane che soffrono di vulvodinia!
Il tuo 5 per Mille per 1 donna su 7 Codice Fiscale 97 82 56 90 585
• Non sono un medico.
Tutti i consigli vanno seguiti sotto la propria respons-abilità e valutati col proprio medico curante, al quale nessuno senza gli stessi titoli e autorizzazioni può legalmente ed eticamente sostituirsi.
.
VULVODINIA.INFO ONLUS non è e non può essere ritenuto in alcun modo responsabile dei contenuti dei messaggi presenti nel Forum, scritti e inviati autonomamente dagli Utenti sotto loro piena e totale respons-abilità.
.
VULVODINIA.INFO ONLUS si riserva la facoltà, a suo insindacabile giudizio, di eliminare/modificare dal Forum i post aventi contenuto illegittimo, illegale o comunque lesivo di altrui diritti e dei contenuti ritenuti non in linea con il Regolamento completo e aggiornato della comunità.
.
I gestori di VULVODINIA.INFO ONLUS non si assumono in alcun modo alcuna respons-abilità per eventuali danni derivati a persone e cose tramite i messaggi inseriti nel Forum.
 Re: Correlazione MBL (Mannose Binding Lectine) - Vulvodinia • VULVODINIA.INFO
Re: Correlazione MBL (Mannose Binding Lectine) - Vulvodinia • VULVODINIA.INFO
Mar 02 Nov 2010, 21:05
La lectina legante il mannosio (Mannose binding lectin - MBL), conosciuta anche come proteina legante il mannosio o proteina legante il
mannano, è un fattore importante nell’immunità ereditaria. La MBL appartiene alla classe delle collectine, superfamiglia della lectina di tipo C, la
cui funzione è il riconoscimento nei meccanismi immediati di difesa nell’ospite pre-immune.
La MBL riconosce i diversi carboidrati presenti sulla superficie di numerosi microrganismi patogeni, tra cui batteri, virus, protozoi e funghi
(1,2,3).
Il legame MBL – microrganismo induce l’attivazione della via classica del complemento molto prima che si formino anticorpi specifici. La MBL ha
una struttura oligomerica (400-700 kDa), formata da subunità a loro volta costituite da tre catene peptidiche identiche, ognuna di 32 kDa.
Sebbene la MBL sia in grado di formare diversi oligomeri, è stato visto che i dimeri ed i trimeri non sono biologicamente attivi e, per l’attivazione
del complemento, è necessario almeno un tetrametro.
Le catene peptidiche sono formate da una parte di lectina e da una parte simile al collagene. La parte di lectina si lega via “sito di riconoscimento
dei carboidrati” a diversi zuccheri quali: mannosio, maltosio, N-acetilglucosammina, N-acetilgalattosamina, fucosio e glucosio. Il legame ha una
bassa affinità (Kd 10-3) e, affinché sia funzionale, è fondamentale che più lectine di una molecola di MBL si leghino simultaneamente (4).
In circolazione, la MBL forma un complesso funzionale con le serinaproteasi associata alla MBL (MBL-associated serine protease - MASPs ) 1, 2
e 3 che, dopo il legame con un microrganismo, diventa enzimaticamente attivo. La MASP-2 è identica all’esterasi-C1 nella via classica del
complemento ed è in grado di scindere C4 e C2, formando C4b2a.
C4b2a agisce come una C3-convertasi scindendo C3, formando C3b ed inducendo in questo modo l’opsonizzazione del microrganismo (2).
Inoltre, si è visto che la MBL si lega direttamente ai recettori della collectina sulla superficie dei fagociti e si ipotizza che la stessa sia in grado di
legarsi al recettore C1q presente su granulociti neutrofili, monociti e macrofagi. Il legame con cellule effettrici può stimolare la produzione di
citochine infiammatorie.
La MBL è una proteina della fase acuta ed è sintetizzata dagli epatociti. Subito dopo il parto, la concentrazione plasmatica della MBL passa da
1000 ng/mL ad un massimo di 2500 ng/mL entro poche settimane, dopo di che scende progressivamente fino ad arrivare a 1700 ng/mL negli
adulti. Le concentrazioni individuali di MBL variano notevolmente e possono aumentare fino a 20 volte durante la reazione dell’infiammazione
acuta.
In quanto parte del sistema immunitario innato, la MBL è importante nel periodo che segue il parto, quando la concentrazione degli anticorpi
materni diminuisce e deve cominciare la produzione di IgG del neonato. In aggiunta, la MBL gioca un ruolo importante ad ogni età durante le
prime fasi di contatto con il microrganismo, prima dell’aumento della concentrazione di IgM.
Rilevanza clinica della MBL
L’incidenza del deficit di MBL è relativamente elevata se confrontata con altre carenze del sistema del complemento e riguarda il 20 – 25% circa
della popolazione totale.
Il deficit di MBL è associato ad una maggiore suscettibilità ad infezioni quali otite media, polmonite, gastroenterite, meningite, osteomielite e
sepsi.
Nei bambini, una mutazione eterozigote del gene della MBL raddoppia il rischio di ospedalizzazione dovuto a malattie infettive rispetto a bambini
con livelli di MBL normali.
In caso di mutazione omozigote del gene, il rischio di infezioni è anche maggiore ed il decorso della malattia è peggiore rispetto a quanto si
verifica in pazienti con livelli di MBL normali.
I pazienti affetti da fibrosi cistica con una mutazione nel gene MBL sono più suscettibili alle infezioni da Pseudomonas aeruginosa o Burkholderia
cepacia ed hanno una minore aspettativa di vita rispetto ai pazienti affetti da fibrosi cistica senza la suddetta mutazione (5).
Pazienti oncologici sottoposti a chemioterapia e che, conseguentemente a ciò, sviluppano neutropenia, sono più suscettibili a lunghi periodi di
febbre se hanno una bassa concentrazione di MBL.
In bambini al di sotto di un anno affetti dalla malattia di Kawasaki, l’eventuale carenza di MBL costituisce un fattore di rischio per aneurismi delle
coronarie.
In pazienti positivi all’HIV la progressione dell’AIDS è più veloce in caso di deficienza di MBL.
Il deficit di MBL è associato al verificarsi di aborti spontanei ricorrenti dovuti, verosimilmente, ad infezioni intrauterine.
La carenza di MBL è associata ad autoimmunopatie quali il Lupus eritematoso sistemico (LES) e l’Artrite reumatoide (AR).
La correlazione tra il deficit di MBL e l’incidenza sia delle malattie infettive che delle autoimmunopatie non ha portato solo ad un aumento dei
prodotti diagnostici per la MBL ma ha anche dimostrato la necessità di applicazioni terapeutiche di MBL purificate.
www.sanquin.nl/
mannano, è un fattore importante nell’immunità ereditaria. La MBL appartiene alla classe delle collectine, superfamiglia della lectina di tipo C, la
cui funzione è il riconoscimento nei meccanismi immediati di difesa nell’ospite pre-immune.
La MBL riconosce i diversi carboidrati presenti sulla superficie di numerosi microrganismi patogeni, tra cui batteri, virus, protozoi e funghi
(1,2,3).
Il legame MBL – microrganismo induce l’attivazione della via classica del complemento molto prima che si formino anticorpi specifici. La MBL ha
una struttura oligomerica (400-700 kDa), formata da subunità a loro volta costituite da tre catene peptidiche identiche, ognuna di 32 kDa.
Sebbene la MBL sia in grado di formare diversi oligomeri, è stato visto che i dimeri ed i trimeri non sono biologicamente attivi e, per l’attivazione
del complemento, è necessario almeno un tetrametro.
Le catene peptidiche sono formate da una parte di lectina e da una parte simile al collagene. La parte di lectina si lega via “sito di riconoscimento
dei carboidrati” a diversi zuccheri quali: mannosio, maltosio, N-acetilglucosammina, N-acetilgalattosamina, fucosio e glucosio. Il legame ha una
bassa affinità (Kd 10-3) e, affinché sia funzionale, è fondamentale che più lectine di una molecola di MBL si leghino simultaneamente (4).
In circolazione, la MBL forma un complesso funzionale con le serinaproteasi associata alla MBL (MBL-associated serine protease - MASPs ) 1, 2
e 3 che, dopo il legame con un microrganismo, diventa enzimaticamente attivo. La MASP-2 è identica all’esterasi-C1 nella via classica del
complemento ed è in grado di scindere C4 e C2, formando C4b2a.
C4b2a agisce come una C3-convertasi scindendo C3, formando C3b ed inducendo in questo modo l’opsonizzazione del microrganismo (2).
Inoltre, si è visto che la MBL si lega direttamente ai recettori della collectina sulla superficie dei fagociti e si ipotizza che la stessa sia in grado di
legarsi al recettore C1q presente su granulociti neutrofili, monociti e macrofagi. Il legame con cellule effettrici può stimolare la produzione di
citochine infiammatorie.
La MBL è una proteina della fase acuta ed è sintetizzata dagli epatociti. Subito dopo il parto, la concentrazione plasmatica della MBL passa da
1000 ng/mL ad un massimo di 2500 ng/mL entro poche settimane, dopo di che scende progressivamente fino ad arrivare a 1700 ng/mL negli
adulti. Le concentrazioni individuali di MBL variano notevolmente e possono aumentare fino a 20 volte durante la reazione dell’infiammazione
acuta.
In quanto parte del sistema immunitario innato, la MBL è importante nel periodo che segue il parto, quando la concentrazione degli anticorpi
materni diminuisce e deve cominciare la produzione di IgG del neonato. In aggiunta, la MBL gioca un ruolo importante ad ogni età durante le
prime fasi di contatto con il microrganismo, prima dell’aumento della concentrazione di IgM.
Rilevanza clinica della MBL
L’incidenza del deficit di MBL è relativamente elevata se confrontata con altre carenze del sistema del complemento e riguarda il 20 – 25% circa
della popolazione totale.
Il deficit di MBL è associato ad una maggiore suscettibilità ad infezioni quali otite media, polmonite, gastroenterite, meningite, osteomielite e
sepsi.
Nei bambini, una mutazione eterozigote del gene della MBL raddoppia il rischio di ospedalizzazione dovuto a malattie infettive rispetto a bambini
con livelli di MBL normali.
In caso di mutazione omozigote del gene, il rischio di infezioni è anche maggiore ed il decorso della malattia è peggiore rispetto a quanto si
verifica in pazienti con livelli di MBL normali.
I pazienti affetti da fibrosi cistica con una mutazione nel gene MBL sono più suscettibili alle infezioni da Pseudomonas aeruginosa o Burkholderia
cepacia ed hanno una minore aspettativa di vita rispetto ai pazienti affetti da fibrosi cistica senza la suddetta mutazione (5).
Pazienti oncologici sottoposti a chemioterapia e che, conseguentemente a ciò, sviluppano neutropenia, sono più suscettibili a lunghi periodi di
febbre se hanno una bassa concentrazione di MBL.
In bambini al di sotto di un anno affetti dalla malattia di Kawasaki, l’eventuale carenza di MBL costituisce un fattore di rischio per aneurismi delle
coronarie.
In pazienti positivi all’HIV la progressione dell’AIDS è più veloce in caso di deficienza di MBL.
Il deficit di MBL è associato al verificarsi di aborti spontanei ricorrenti dovuti, verosimilmente, ad infezioni intrauterine.
La carenza di MBL è associata ad autoimmunopatie quali il Lupus eritematoso sistemico (LES) e l’Artrite reumatoide (AR).
La correlazione tra il deficit di MBL e l’incidenza sia delle malattie infettive che delle autoimmunopatie non ha portato solo ad un aumento dei
prodotti diagnostici per la MBL ma ha anche dimostrato la necessità di applicazioni terapeutiche di MBL purificate.
www.sanquin.nl/
 Aida Blanchett
Aida Blanchett
Elena Tione Presidente VULVODINIA.INFO ONLUS
 Qualifica professionale :
Qualifica professionale :
Mind-Body Health Coach per donne con dolore pelvico
Esci dal dolore ed Entra nella Tua Vita (c)!
Scopri come dire addio al tuo dolore pelvico
www.aidablanchett.com/mindbodynews
Instagram
www.instagram.com/elenationehealthylifecoach
Messaggi : 16107
Iscritto il : 17.10.10
Anno di nascita : 1977
Provincia di residenza : Roma
Comune : Roma Storia personale : • LA MIA STORIA e la fondazione di VULVODINIA.INFO e VULVODINIA.INFO ONLUS
Storia personale : • LA MIA STORIA e la fondazione di VULVODINIA.INFO e VULVODINIA.INFO ONLUS

Anche quest'anno non dimenticarti delle oltre 4 milioni di italiane che soffrono di vulvodinia!
Il tuo 5 per Mille per 1 donna su 7 Codice Fiscale 97 82 56 90 585
• Non sono un medico.
Tutti i consigli vanno seguiti sotto la propria respons-abilità e valutati col proprio medico curante, al quale nessuno senza gli stessi titoli e autorizzazioni può legalmente ed eticamente sostituirsi.
.
VULVODINIA.INFO ONLUS non è e non può essere ritenuto in alcun modo responsabile dei contenuti dei messaggi presenti nel Forum, scritti e inviati autonomamente dagli Utenti sotto loro piena e totale respons-abilità.
.
VULVODINIA.INFO ONLUS si riserva la facoltà, a suo insindacabile giudizio, di eliminare/modificare dal Forum i post aventi contenuto illegittimo, illegale o comunque lesivo di altrui diritti e dei contenuti ritenuti non in linea con il Regolamento completo e aggiornato della comunità.
.
I gestori di VULVODINIA.INFO ONLUS non si assumono in alcun modo alcuna respons-abilità per eventuali danni derivati a persone e cose tramite i messaggi inseriti nel Forum.
 Re: Correlazione MBL (Mannose Binding Lectine) - Vulvodinia • VULVODINIA.INFO
Re: Correlazione MBL (Mannose Binding Lectine) - Vulvodinia • VULVODINIA.INFO
Mar 02 Nov 2010, 21:10
Sistema del complemento
Indice:
1. Storia
2. Attivazione del complemento
3. Conseguenze biologiche dell'attivazione del complemento
4. Voci correlate
5. Bibliografia
1. Storia
2. 1. Via classica

2. 4. Attivazione del complesso litico

Anche in questo caso esistono due convertasi strutturalmente diverse a seconda della via che le ha generate.
Mediante queste attività il complemento svolge un ruolo importantissimo nel sistema umorale di difesa contro le aggressioni esterne.
Oltre a quanto già esposto il complemento interviene in altre importanti fasi della risposta immunitaria.
3. 4. 2. Attivazione dei B-linfociti
Una proteina prodotta nella scissione del C3, chiamata C3d, interagisce con il rispettivo recettore espresso sulla membrana dei B-linfociti, recettore CR2, innescando l'inizio della risposta umorale, cioè della produzione di anticorpi.
4. Voci correlate
Anticorpo
Immunochimica
Macrofago
Opsonine
5. Bibliografia
Abul K.Abbas, Andrew H.Lichtman, Jordan S.Pober. Immunologia cellulare e molecolare. Padova, Piccin, 2002. ISBN 88-299-1622-6
Lorenzo Bonomo. Immunologia clinica. Torino, UTET, 1992. ISBN 88-02-04544-5.
Jean-François Bach, Philippe Lesavre. Immunologie. Paris, Flammarion Médecine Sciences, 1981.
Giuseppe Tridente. Immunologia e immunopatologia. Roma, Il pensiero scientifico, 1981.
Abul K.Abbas, Andrew H.Lichtman. Fondamenti di Immunologia. Funzioni e alterazioni del sistema immunitario. Padova, Piccin, 2002.
Il sistema del complemento, insieme con gli anticorpi, rappresenta l'elemento essenziale dei meccanismi di difesa umorali contro gli agenti infettivi. Esso è costituito da una ventina di proteine circolanti e di membrana, capaci di interagire reciprocamente e con le membrane cellulari. L'attivazione a cascata delle sue proteine solubili, che convenzionalmente vengono chiamate componenti, è alla base di attività biologiche varie come la lisi cellulare, batterica o virale, queste si introducono nelle membrane degli agenti patogeni provocando su di esse pori che portano alla lisi. Durante l'attivazione del complemento si ha inoltre il reclutamento di varie cellule immunocompetenti, quali cellule fagocitarie (monociti, macrofagi, polinucleati), linfociti B e linfociti T.
Indice:
1. Storia
2. Attivazione del complemento
3. Conseguenze biologiche dell'attivazione del complemento
4. Voci correlate
5. Bibliografia
1. Storia
Il termine complemento fu usato per la prima volta nel 1898 da J. Bordet che aveva notato che, se incubava una miscela di batteri con siero contenente anticorpi rivolti contro i batteri stessi, questi venivano lisati (distrutti); se invece il siero veniva riscaldato ad una temperatura di 56° la lisi non avveniva. Poiché era stato già dimostrato che gli anticorpi resistevano al riscaldamento, Bordet ipotizzò la presenza nel siero di un componente termolabile che completava l'azione degli anticorpi e che battezzò appunto complemento.
2. Attivazione del complemento
Come accade per altri sistemi operanti nell'organismo, quali quello della coagulazione e quello delle chinine, l'attivazione del complemento avviene con un meccanismo detto a cascata per attivazione sequenziale dei vari componenti complementari che circolano in forma inattiva.
Esistono due vie distinte (c'è anche una terza via, detta via della lectina legante il mannosio, MBL) di attivazione del complemento, la via classica e la via alternativa, che partendo da momenti differenti conducono entrambe alla proteolisi del C3. Da questo evento centrale, la attivazione delle altre componenti procede attraverso una via comune che porta alla formazione del complesso di attacco della membrana (MAC), il quale, legandosi alle membrane cellulari dei microorganismi, ne determina la lisi osmotica.
La via classica è attivata dal legame di alcune classi di anticorpi con il relativo antigene e quindi rappresenta un meccanismo dell'immunità umorale specifica. La via alternativa viene attivata direttamente da alcune proteine delle membrane cellulari dei microbi e quindi fa parte dei meccanismi della immunità naturale. La via della lectina legante il mannosio utilizza il mannosio come sito di attacco alle membrane dei patogeni.
Alcune proteine presenti sulle cellule normali dell'ospite inibiscono l'attivazione del complemento e questo riduce al minimo l'effetto dannoso che il complemento potrebbe esplicare sulle cellule dell'ospite. I microorganismi invece non posseggono tali proteine, pertanto il sistema complementare può svolgere interamente la sua azione sulla loro membrana.
2. Attivazione del complemento
Come accade per altri sistemi operanti nell'organismo, quali quello della coagulazione e quello delle chinine, l'attivazione del complemento avviene con un meccanismo detto a cascata per attivazione sequenziale dei vari componenti complementari che circolano in forma inattiva.
Esistono due vie distinte (c'è anche una terza via, detta via della lectina legante il mannosio, MBL) di attivazione del complemento, la via classica e la via alternativa, che partendo da momenti differenti conducono entrambe alla proteolisi del C3. Da questo evento centrale, la attivazione delle altre componenti procede attraverso una via comune che porta alla formazione del complesso di attacco della membrana (MAC), il quale, legandosi alle membrane cellulari dei microorganismi, ne determina la lisi osmotica.
La via classica è attivata dal legame di alcune classi di anticorpi con il relativo antigene e quindi rappresenta un meccanismo dell'immunità umorale specifica. La via alternativa viene attivata direttamente da alcune proteine delle membrane cellulari dei microbi e quindi fa parte dei meccanismi della immunità naturale. La via della lectina legante il mannosio utilizza il mannosio come sito di attacco alle membrane dei patogeni.
Alcune proteine presenti sulle cellule normali dell'ospite inibiscono l'attivazione del complemento e questo riduce al minimo l'effetto dannoso che il complemento potrebbe esplicare sulle cellule dell'ospite. I microorganismi invece non posseggono tali proteine, pertanto il sistema complementare può svolgere interamente la sua azione sulla loro membrana.
2. 1. Via classica

Attivazione della via classica del complemento e formazione della C3 convertasi della via classica
L'attivazione della via classica dipende dalla interazione di tre proteine del complemento, C1, C4 e C2, con il complesso antigene-anticorpo. La reazione inizia con il legame del C1 alle immunoglobuline di tipo IgG1, IgG3 e IgM fissate ad un antigene multivalente. Il primo componente del complemento (C1) è costituito da tre sub componenti, C1q, C1r e C1s. Il C1q, composto da sei catene disposte radialmente ad ombrello, e svolge un'azione di ricognizione legandosi specificamente alla regione Fc delle immunoglobuline. Il C1r e il C1s svolgono invece una azione enzimatica: il legame di due o più catene di C1q alle immunoglobuline attiva il C1r che a sua volta attiva il C1s. Il C1s scinde enzimaticamente la seconda componente della cascata complementare il C4 in due frazioni: il C4a che rimane in circolo e il C4b che si lega covalentemente alla membrana. C1s attiva il C2 in due frazioni: la C2a e la C2b. La C2a rimane in fase fluida mentre la C2b si lega al precedente dando luogo al complesso C4b-C2b. Questo costituisce l'enzima chiamato C3 convertasi della via classica, capace di legarsi al C3 e di scinderlo. Il C3 viene scisso in C3a (anafilotossina) e in C3b che si lega alla membrana batterica con finalità opsonizzanti.
2. 2. Via alternativa
L’attivazione della via alternativa porta alla formazione di C3 proteasi e quindi alla scissione del C3 senza il contributo di anticorpi.
In condizioni normali si verifica continuamente la scissione del C3 circolante ad un ritmo lentissimo con formazione di piccolissime quantità di C3b. Questo se rimane in circolo viene inattivato rapidamente; se invece si lega alle superfici di cellule, per esempio batteriche, esso può associarsi ad una proteina plasmatica chiamata Fattore B. Appena legatosi al C3b il fattore B perde un piccolo frammento (frammento Ba) ad opera di una proteasi chiamata fattore D. Il frammento residuo, Bb, rimane legato al C3b costituendo il complesso C3b-Bb che rappresenta la C3 convertasi della via alternativa.
La C3 convertasi è capace di scindere grandi quantità di C3 con rapida amplificazione del processo ma solo se il complesso C3bBb viene a formarsi su membrane batteriche e non quelle delle cellule di mammiferi, in quanto queste ultime posseggono delle proteine che degradano la C3 convertasi arrestando la cascata.
2. 3. Via della lectina legante il mannosio
La via della lectina legante il mannosio utilizza una proteina molto simile a C1q, la lectina legante il mannosio o MBL (mannose-binding-lectine).
Questa proteina lega specificamente residui di mannosio, di fucosio e di altri zuccheri, che sono presenti sulle superfici cellulari di molti patogeni, legati a proteine o lipidi. Sulla superficie cellulare dei vertebrati sono presenti altri tipi di zuccheri, ad esempio l'acido sialico.
In questo modo la MBL è in grado di discriminare il tipo di membrana di attacco e di innescare l'attivazione del complemento esclusivamente sulla superficie del patogeno.
Proprio come C1q, MBL è una molecola con sei teste che forma un complesso con due ziomogeni proteasici, MASP-1 e MASP-2. Insieme queste proteine formano il MBL complex. MASP-1 e MASP-2 sono strettamente omologhi a C1r e C1s.
Quando il MBL complex lega la superficie del patogeno, MASP-1 e MASP-2 vengono attivate, tagliando C4 e C2 e permettendo la formazione di una C3 convertasi dal legame del complesso C2a-C4b, proprio come nella via classica
L'attivazione della via classica dipende dalla interazione di tre proteine del complemento, C1, C4 e C2, con il complesso antigene-anticorpo. La reazione inizia con il legame del C1 alle immunoglobuline di tipo IgG1, IgG3 e IgM fissate ad un antigene multivalente. Il primo componente del complemento (C1) è costituito da tre sub componenti, C1q, C1r e C1s. Il C1q, composto da sei catene disposte radialmente ad ombrello, e svolge un'azione di ricognizione legandosi specificamente alla regione Fc delle immunoglobuline. Il C1r e il C1s svolgono invece una azione enzimatica: il legame di due o più catene di C1q alle immunoglobuline attiva il C1r che a sua volta attiva il C1s. Il C1s scinde enzimaticamente la seconda componente della cascata complementare il C4 in due frazioni: il C4a che rimane in circolo e il C4b che si lega covalentemente alla membrana. C1s attiva il C2 in due frazioni: la C2a e la C2b. La C2a rimane in fase fluida mentre la C2b si lega al precedente dando luogo al complesso C4b-C2b. Questo costituisce l'enzima chiamato C3 convertasi della via classica, capace di legarsi al C3 e di scinderlo. Il C3 viene scisso in C3a (anafilotossina) e in C3b che si lega alla membrana batterica con finalità opsonizzanti.
2. 2. Via alternativa
L’attivazione della via alternativa porta alla formazione di C3 proteasi e quindi alla scissione del C3 senza il contributo di anticorpi.
In condizioni normali si verifica continuamente la scissione del C3 circolante ad un ritmo lentissimo con formazione di piccolissime quantità di C3b. Questo se rimane in circolo viene inattivato rapidamente; se invece si lega alle superfici di cellule, per esempio batteriche, esso può associarsi ad una proteina plasmatica chiamata Fattore B. Appena legatosi al C3b il fattore B perde un piccolo frammento (frammento Ba) ad opera di una proteasi chiamata fattore D. Il frammento residuo, Bb, rimane legato al C3b costituendo il complesso C3b-Bb che rappresenta la C3 convertasi della via alternativa.
La C3 convertasi è capace di scindere grandi quantità di C3 con rapida amplificazione del processo ma solo se il complesso C3bBb viene a formarsi su membrane batteriche e non quelle delle cellule di mammiferi, in quanto queste ultime posseggono delle proteine che degradano la C3 convertasi arrestando la cascata.
2. 3. Via della lectina legante il mannosio
La via della lectina legante il mannosio utilizza una proteina molto simile a C1q, la lectina legante il mannosio o MBL (mannose-binding-lectine).
Questa proteina lega specificamente residui di mannosio, di fucosio e di altri zuccheri, che sono presenti sulle superfici cellulari di molti patogeni, legati a proteine o lipidi. Sulla superficie cellulare dei vertebrati sono presenti altri tipi di zuccheri, ad esempio l'acido sialico.
In questo modo la MBL è in grado di discriminare il tipo di membrana di attacco e di innescare l'attivazione del complemento esclusivamente sulla superficie del patogeno.
Proprio come C1q, MBL è una molecola con sei teste che forma un complesso con due ziomogeni proteasici, MASP-1 e MASP-2. Insieme queste proteine formano il MBL complex. MASP-1 e MASP-2 sono strettamente omologhi a C1r e C1s.
Quando il MBL complex lega la superficie del patogeno, MASP-1 e MASP-2 vengono attivate, tagliando C4 e C2 e permettendo la formazione di una C3 convertasi dal legame del complesso C2a-C4b, proprio come nella via classica
2. 4. Attivazione del complesso litico

Attacco del complesso MAC (formato dalle componenti C5,C6,C7,C8,C9 del complemento) ad una membrana cellulare. Seguirà la distruzione osmotica della cellula stessa
Come illustrato, le due vie di attivazione del complemento, la classica e l’alternativa, portano alla costituzione di due complessi diversi, il C4b-C2a e il C3b-Bb, ma con una identica funzione: quella di scindere il C3 in due frammenti, C3a e C3b, e di legarsi al C3b costituendo le C5 convertasi.
Come illustrato, le due vie di attivazione del complemento, la classica e l’alternativa, portano alla costituzione di due complessi diversi, il C4b-C2a e il C3b-Bb, ma con una identica funzione: quella di scindere il C3 in due frammenti, C3a e C3b, e di legarsi al C3b costituendo le C5 convertasi.
Anche in questo caso esistono due convertasi strutturalmente diverse a seconda della via che le ha generate.
Le C5 convertasi comunque originate, per la via alternativa o per la via classica, innescano l’attivazione delle componenti finali del sistema del complemento che conducono alla formazione del MAC (Membrane Attack Complex) e alla distruzione della cellula.
Le C5 convertasi clivano (scindono) il C5 in due frammenti C5a che rimane in soluzione espletando importanti funzioni e il C5b che si lega alla membrana cellulare. Le restanti componenti della cascata complementare (C6, C7, C8, C9) se pur prive di attività enzimatica, si legano conseguenzialmente alla membrana cellulare inserendosi nel contesto dello strato lipidico della parete cellulare. L'ultimo componente della cascata, il C9, ha la capacità di polimerizzare nel punto in cui si è inserito formando dei pori nella membrana cellulare di circa 100A°. Attraverso i pori prodotti dalla polimerizzazione del C9, l'acqua e gli ioni hanno libero accesso all'interno della cellula determinandone dapprima il rigonfiamento osmotico e quindi lo scoppio della stessa.
3. Conseguenze biologiche dell'attivazione del complemento
L'attivazione del complemento genera la formazione di un gran numero di prodotti dotati di attività biologiche diverse: alcuni si depositano sulla superficie delle particelle attivatrici, provocandone la lisi (complesso MAC) oppure la fagocitosi (C3b). Altri come il C3a e il C5a provocano una reazione infiammatoria locale.
L'attivazione del complemento genera la formazione di un gran numero di prodotti dotati di attività biologiche diverse: alcuni si depositano sulla superficie delle particelle attivatrici, provocandone la lisi (complesso MAC) oppure la fagocitosi (C3b). Altri come il C3a e il C5a provocano una reazione infiammatoria locale.
Mediante queste attività il complemento svolge un ruolo importantissimo nel sistema umorale di difesa contro le aggressioni esterne.
3. 1. Opsonizzazione e fagocitosi
Per approfondire, vedi la voce opsonine.
I frammenti C3b o C4b, derivanti dall'attivazione della via classica o della via alternativa del complemento, rivestono il microrganismo che ne ha provocato l'attivazione e legandosi ai relativi recettori specifici espressi sui neutrofili e sui macrofagi ne attivano la fagocitosi cioè l'inglobamento del microrganismo all'interno di queste cellule.
Per approfondire, vedi la voce opsonine.
I frammenti C3b o C4b, derivanti dall'attivazione della via classica o della via alternativa del complemento, rivestono il microrganismo che ne ha provocato l'attivazione e legandosi ai relativi recettori specifici espressi sui neutrofili e sui macrofagi ne attivano la fagocitosi cioè l'inglobamento del microrganismo all'interno di queste cellule.
Le cellule fagocitiche infatti posseggono sulla loro superficie cellulare dei recettori specifici per il C3b e il C4b che pertanto fungono da opsonine innescando il processo di fagocitosi.
3. 2. Induzione della risposta infiammatoria
La proteolisi dei componenti C3,C4 e C5 genera i relativi frammenti b che si assemblano tra loro nelle varie fasi di attivazione del complemento e i frammenti C3a, C4a e C5a, detti anafilotossine. Queste inducono l'infiammazione fissandosi ai relativi recettori di membrana presenti sui mastociti, sui neutrofili, sulle cellule endoteliali nonché sui basofili, eosinofili, monociti e altre. Le principali azioni che ne derivano sono le seguenti
: La proteolisi dei componenti C3,C4 e C5 genera i relativi frammenti b che si assemblano tra loro nelle varie fasi di attivazione del complemento e i frammenti C3a, C4a e C5a, detti anafilotossine. Queste inducono l'infiammazione fissandosi ai relativi recettori di membrana presenti sui mastociti, sui neutrofili, sulle cellule endoteliali nonché sui basofili, eosinofili, monociti e altre. Le principali azioni che ne derivano sono le seguenti
degranulazione dei mastociti con liberazione di mediatori vasoattivi.
chemiotassi dei neutrofili e adesione degli stessi alle cellule endoteliali(in particolare C5a).
aumento della permeabilità vascolare per azione diretta sulle cellule endoteliali.
espressione della P-selectina sulle membrane endoteliali che favorisce l'adesione dei neutrofili.
3. 3. Lesioni delle membrane cellulari
Come già esposto, il complesso di attacco delle membrane (MAC) è responsabile della lisi osmotica delle cellule estranee. Ma in realtà tale meccanismo di difesa dell'organismo è rilevante solo per le infezioni da Neisserie. Questo è infatti quanto si osserva nei difetti genetici dei componenti del MAC.
3. 4. Altre funzioni del sistema del complemento chemiotassi dei neutrofili e adesione degli stessi alle cellule endoteliali(in particolare C5a).
aumento della permeabilità vascolare per azione diretta sulle cellule endoteliali.
espressione della P-selectina sulle membrane endoteliali che favorisce l'adesione dei neutrofili.
3. 3. Lesioni delle membrane cellulari
Come già esposto, il complesso di attacco delle membrane (MAC) è responsabile della lisi osmotica delle cellule estranee. Ma in realtà tale meccanismo di difesa dell'organismo è rilevante solo per le infezioni da Neisserie. Questo è infatti quanto si osserva nei difetti genetici dei componenti del MAC.
Oltre a quanto già esposto il complemento interviene in altre importanti fasi della risposta immunitaria.
3. 4. 1. Eliminazione dei complessi antigene-anticorpo
In seguito alla risposta immunitaria rivolta verso un determinato antigene solubile, l'individuo reagisce con la formazione di anticorpi; questi si legano all'antigene relativo con formazione di complessi immuni circolanti (complessi antigene-anticorpo). Se di dimensioni idonee e in quantità sufficiente gli immunocomplessi possono depositarsi sulle pareti vasali promuovendo una reazione infiammatoria dannosa all'organismo.
Il complemento legandosi ai complessi immuni ne promuove la solubilizzazione e la rimozione da parte delle cellule fagocitiche.
In seguito alla risposta immunitaria rivolta verso un determinato antigene solubile, l'individuo reagisce con la formazione di anticorpi; questi si legano all'antigene relativo con formazione di complessi immuni circolanti (complessi antigene-anticorpo). Se di dimensioni idonee e in quantità sufficiente gli immunocomplessi possono depositarsi sulle pareti vasali promuovendo una reazione infiammatoria dannosa all'organismo.
Il complemento legandosi ai complessi immuni ne promuove la solubilizzazione e la rimozione da parte delle cellule fagocitiche.
3. 4. 2. Attivazione dei B-linfociti
Una proteina prodotta nella scissione del C3, chiamata C3d, interagisce con il rispettivo recettore espresso sulla membrana dei B-linfociti, recettore CR2, innescando l'inizio della risposta umorale, cioè della produzione di anticorpi.
4. Voci correlate
Anticorpo
Immunochimica
Macrofago
Opsonine
5. Bibliografia
Abul K.Abbas, Andrew H.Lichtman, Jordan S.Pober. Immunologia cellulare e molecolare. Padova, Piccin, 2002. ISBN 88-299-1622-6
Lorenzo Bonomo. Immunologia clinica. Torino, UTET, 1992. ISBN 88-02-04544-5.
Jean-François Bach, Philippe Lesavre. Immunologie. Paris, Flammarion Médecine Sciences, 1981.
Giuseppe Tridente. Immunologia e immunopatologia. Roma, Il pensiero scientifico, 1981.
Abul K.Abbas, Andrew H.Lichtman. Fondamenti di Immunologia. Funzioni e alterazioni del sistema immunitario. Padova, Piccin, 2002.
- MBL Mannose Binding Lectine - lectina legante il mannosio- e Candida • VULVODINIA.INFO
- Questionario sulla possibile correlazione Vulvodinia-Pillola anticoncezionale • VULVODINIA.INFO
- Il mio Report "La Vulvodinia" inserito nel sito AIV - Associazione Italiana Vulvodinia Onlus ❖ Vulvodinia.info
- Condividi le discussioni di Vulvodinia.info sui social network per diffondere informazioni preziose e la nostra voce! Funzioni "condividere" e "più" • VULVODINIA.INFO
- Rassegna Stampa • VULVODINIA.INFO
Permessi in questa sezione del forum:
Non puoi rispondere agli argomenti in questo forum.




